腫瘤微環境(TME)是指由腫瘤細胞、免疫細胞等多種細胞與各種信號分子所構成的復雜生態系統,并隨著腫瘤進程發生變化。免疫檢查點抑制劑如PD-1/PD-L1抗體通過恢復腫瘤殺傷性CD8+T細胞功能,提高腫瘤微環境中CD8+T細胞數量與活性,從而提高機體免疫監察能力發揮抗腫瘤效應。盡管這種治療方式使得部分病人能夠獲得長期生存受益,在腫瘤治療領域取得了重大成功,但是腫瘤病人腫瘤微環境復雜多變的特性常常導致腫瘤浸潤的CD8+T細胞數量不足或喪失活性,從而使超過70%的腫瘤病人無法有效響應免疫檢查點療法即對免疫檢查點抑制劑產生了先天性耐藥或者獲得性耐藥。由于免疫檢查點療法的耐藥性問題極大地限制了該療法的臨床應用,所以,如何克服免疫檢查點抑制劑耐藥性問題成為腫瘤免疫研究的熱點問題。
為了發現能夠調節腫瘤微環境中CD8+T抗腫瘤免疫的新靶點,為克服免疫檢查點抑制劑耐藥性提供新的策略與思路,中國科學院上海藥物研究所羅成課題組聯合哈爾濱工業大學劉川鵬課題組,發展了基于轉錄組數據預測腫瘤免疫調控靶標的計算生物學方法,并發現精氨酸甲基轉移酶1(PRMT1)是調控黑色素腫瘤微環境中CD8+T細胞浸潤與活化的新靶標,且實驗室自主研發的PRMT1小分子抑制劑能夠顯著提高腫瘤微環境中CD8+T細胞的數量與活性,抑制腫瘤生長并提高耐藥黑色素瘤對PD-1抗體治療的敏感性。該研究論文于2023年11月22日在線發表于Cancer Research。

前期研究中,羅成課題組圍繞表觀遺傳調控蛋白先導化合物發現和化學干預研究開展系統研究,針對蛋白精氨酸甲基轉移酶家族PRMT1、PRMT4、PRMT5、PRMT6蛋白獲得了一系列高活性、高選擇性、母核結構全新的小分子抑制劑(J Med Chem. 2012;55:7978;J Med Chem. 2017;60:8888.;J Med Chem. 2017;60:6289),并以自主研發的PRMT1、PRMT5小分子為化學探針揭示了PRMT家族在腫瘤干性調控、腫瘤耐藥調控方面的全新功能,為PRMT1、PRMT5抑制劑的臨床適應癥應用拓展提供了重要科學依據。此外,團隊與海軍軍醫大學附屬長征醫院謝渭芬主任合作,發現PRMT5抑制劑通過下調肝細胞核因子HNF4α轉錄降低肝癌干性相關基因表達,具有抗肝癌生長活性(Theranostics. 2019,13;9(9):2606-2617)。與上海交通大學醫學院附屬仁濟醫院張進主任合作發現PRMT1抑制劑可克服腎透明細胞癌一線藥物舒尼替尼耐藥,揭示PRMT1調控耐藥逃逸通路LCN2-pAKT-pRb激活、導致舒尼替尼耐藥的表觀遺傳機制,并提出PRMT1抑制劑克服腎癌耐藥的聯用治療新策略(Theranostics. 2021,11(11):5387-5403)。
與中國科學院分子細胞科學卓越創新中心高棟研究員合作,發現代謝物精胺抑制去勢抵抗性前列腺腫瘤生長并克服恩雜魯胺耐藥的新功能,揭示代謝物作用于表觀遺傳靶標PRMT1調控腫瘤耐藥的表觀遺傳分子機制,并提出PRMT1抑制劑可作為去勢抵抗性前列腺腫瘤治療的新策略(Cell Rep. 2023,42(7):112798)。近年來,課題組通過開展腫瘤免疫調控新靶標和小分子研究,發現了代謝物L-5-羥基色氨酸抑制PD-L1/L2表達而激活T細胞抗腫瘤免疫的新功能,為L-5-HTP應用于癌癥免疫治療以及改善腫瘤患者的抑郁行為提供了理論依據(J Immunother Cancer. 2022,10(6):e003957),發現了可調控髓系抑制細胞MDSC提高放療和放療免疫檢查點聯合治療效果的“m6A閱讀子”YTHDF2小分子抑制劑(Cancer Cell. 2023,41(7):1294-1308)。
在前期研究基礎上,團隊綜合表達了差異、生存分析、CD8+T細胞相關性分析、免疫活細胞殺傷性評分(CYT)等序貫篩選,發展了腫瘤殺傷性T細胞調控靶標預測的計算生物學方法,并基于TCGA數據庫469位黑色素瘤患者基因表達譜進行分析和篩選,發現了抑制黑色素腫瘤微環境內CD8+T細胞浸潤與激活的潛在新靶標PRMT1。團隊經過進一步動物水平功能評價,確證了PRMT1敲除顯著降低同系免疫完整小鼠上黑色素腫瘤內的CD8+T細胞數量和IFNγ+CD8+T比例,延緩腫瘤生長,而在免疫缺陷荷瘤小鼠上PRMT1敲除對腫瘤生長的抑制作用顯著降低。同系免疫完整小鼠模型上,CD8+T細胞中和抗體顯著降低了PRMT1敲除的腫瘤生長抑制作用。表明敲除黑色素細胞內源PRMT1能夠增加腫瘤組織內CD8+T細胞與活性,并以CD8+T細胞依賴的方式發揮顯著的抗腫瘤效應。
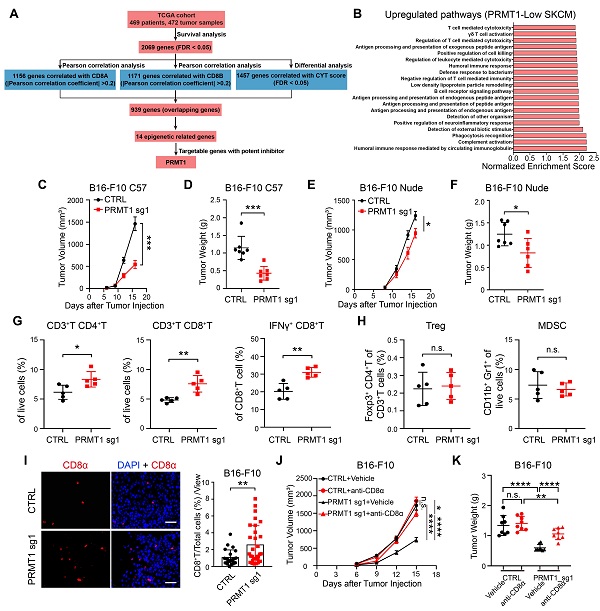
圖1. PRMT1抑制黑色素瘤微環境中T細胞的浸潤與激活
結合轉錄組與染色質免疫共沉淀組分析,機制研究發現敲除黑色素細胞內PRMT1能夠降低DNA甲基轉移酶1(DNMT1)基因的增強子區域H4R3me2a與H3K27ac修飾水平,抑制增強子活性,降低DNMT1的轉錄表達。下調的DNMT1進一步激活了腫瘤細胞內逆轉錄病毒元件(ERVs)的轉錄表達,并促進ERV來源的雙鏈RNA(dsRNA)在細胞質內累積,進而激活dsRNA識別通路與I型干擾素通路,最終促進I型干擾素下游的TH1型趨化因子CXCL9/10/11的表達。TH1型趨化因子被報道能夠有效的招募CD8+T細胞至腫瘤組織內部并促進CD8+T細胞的激活。至此,該研究闡明了PRMT1調控黑色素腫瘤微環境內CD8+T細胞浸潤與激活的表觀遺傳分子機制。
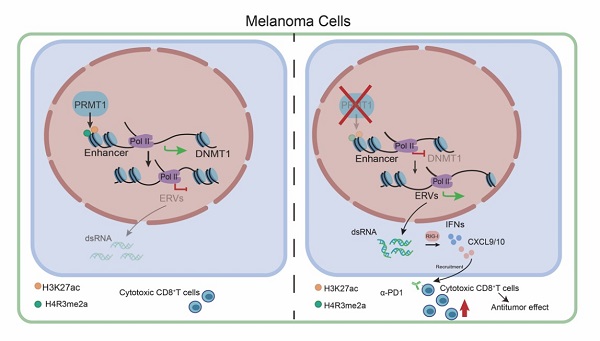
圖2 PRMT1調控DNMT1-ERVs-dsRNA-IFNs信號通路模式圖
最終,運用自主開發的PRMT1的抑制劑DCPT1061,研究團隊評估了PRMT1抑制劑聯合免疫檢查點抑制劑PD-1抗體在低免疫原性、PD-1抗體治療不響應的黑色素腫瘤模型中的抗腫瘤效應。結果表明,在對免疫檢查點抑制劑治療原發性耐藥的B16-F10黑色素腫瘤上,PRMT1抑制劑DCPT1061增加腫瘤浸潤CD8+T細胞的數量與活性,提高耐藥黑色素瘤對PD-1抗體治療的敏感性。
綜上所述,該研究開發了腫瘤殺傷性T細胞調控靶標預測的計算生物學方法,發現了PRMT1是黑色素腫瘤微環境CD8+T細胞浸潤和活性調控的重要靶標,闡明了表觀修飾酶PRMT1參與CD8+T細胞相關腫瘤免疫調節的全新功能與表觀遺傳分子機制,提示了PRMT1抑制劑在腫瘤免疫治療、克服免疫檢查點抑制劑耐藥方面的應用前景。
上海藥物所與哈爾濱工業大學聯合培養博士研究生陶泓儒、南京中醫藥大學碩士研究生金晨、中國科學院杭州高等研究院碩士研究生周禮源及上海交通大學附屬新華醫院主治醫師鄧振忠為該論文的共同第一作者。上海藥物所羅成研究員、張元元研究員和哈爾濱工業大學的劉川鵬副教授為該論文的共同通訊作者。該研究還得到了中國科學院廣州生物醫藥與健康研究院孔祥謙研究員、德國海德堡大學盧俊彥教授、浙江理工大學葉飛教授的支持,得到國家重點研發計劃、國家自然科學基金、上海市自然科學基金等項目的資助。
全文鏈接:https://pubmed.ncbi.nlm.nih.gov/37991725/(供稿部門:羅成課題組)





 17312606166
17312606166