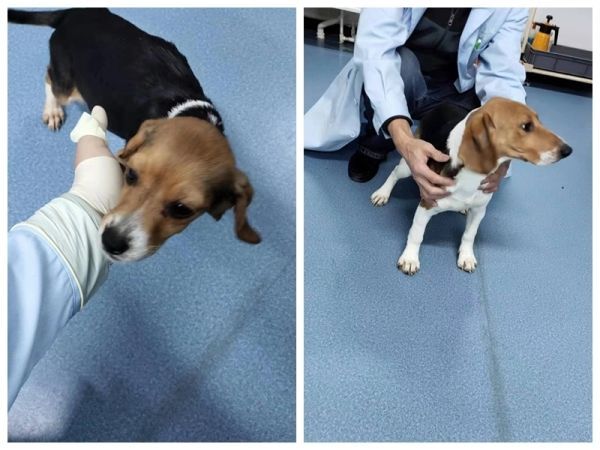
近日,中國科學院廣州生物醫藥與健康研究院科研人員及其合作者利用單堿基編輯器對葡萄糖激酶進行點突變,培育出首例人類永久性新生兒糖尿病犬模型。相關論文以Generation of permanent neonatal diabetes mellitus dogs with glucokinase point mutations through base editing為題,在線發表在Cell Discovery上。
糖尿病患者中的部分病例發生于新生兒時期,是由與分泌胰島素的β細胞功能相關的基因突變導致的遺傳性糖尿病。葡萄糖激酶(GCK)是葡萄糖代謝過程中的第一個限速酶,也是葡萄糖濃度感受器,在調節血液葡萄糖濃度中起關鍵作用。GCK基因突變在青少年糖尿病中所占比例較大,并且大多數為單核苷酸突變,純合或復合型的雜合突變會導致GCK蛋白完全失活,患者表現出永久性新生兒糖尿病,臨床癥狀包括出生第一天開始高血糖、伴隨有生長緩慢、患者終身需要注射外源胰島素才能存活。獲取能夠準確模擬人類該疾病的動物模型對疾病發生機制開展研究和開發新治療手段具有重要意義。犬是一種雜食性動物,在代謝、生理、生活習性和解剖特征等方面與人類接近,是研究人類糖尿病的理想動物模型。
該研究首次嘗試利用單堿基編輯器對犬GCK基因進行點突變,使GCK基因上的CAG密碼子完成C到T的轉變,從而引入終止密碼子,提前終止GCK的翻譯,使GCK蛋白完全失去活性。其過程是首先從供體犬獲取受精卵,借助顯微操作系統將體外轉錄的堿基編輯器mRNA和sgRNA注射到受精卵中,然后將完成注射的受精卵移植入代孕犬的輸卵管內,使其在體內繼續發育成熟并分娩。實驗共移植56枚受精卵,產下17只幼犬,共獲得4只GCK基因編輯犬,其中3只為純合突變,1只為嵌合體。GCK基因點突變小狗剛出生就表現出高血糖癥狀且生長緩慢,如果不注射外源胰島素,新生犬將在兩周內死亡,如果出生后第一天就開始注射胰島素,新生犬的血糖濃度趨于正常水平,可以長期存活,體重與沒有治療的幼犬相比得到較大程度的恢復。對RNA測序結果進行GO富集分析發現,注射外源胰島素的永久性新生兒糖尿病模型犬能促進脂類和脂肪酸等代謝,使犬的生理指標維持在相對正常的水平,從而能使其存活時間延長,上述特征均與人類永久性新生兒糖尿病癥狀一致。因此,該單堿基基因編輯犬將為研究人類新生兒糖尿病的發生機制和開發新治療方法,如藥物治療、干細胞治療和基因治療等提供理想的動物模型。





 17312606166
17312606166