摘要:心臟毒性仍然是藥物研發失敗的最常見原因。最近用于評估藥物依賴性心臟毒性和識別心臟保護分子的斑馬魚模型已經出現。然而,基于斑馬魚的結果在多大程度上可以實現人類轉化仍然未知。 為了解決這個問題,我們建立了多柔比星、腎上腺素和特非那定誘導的心臟毒性的胚胎斑馬魚模型,采用統一的給藥方案實現了藥物的系統比較。隨后,我們確定了人類心臟保護藥物——右雷佐生、美托洛爾、卡維地洛和纈沙坦——是否能夠治療斑馬魚的心臟功能障礙。我們的研究結果表明,多柔比星、腎上腺素和特非那定在魚類中引起了明顯的心臟毒性跡象,進一步表明阻斷腎素-血管緊張素系統以及在較小程度上阻斷 β-腎上腺素能系統,改善了斑馬魚的心臟病。從藥物開發的角度來看,我們的工作開啟了使用快速且經濟實惠的斑馬魚模型確定測試化合物的心血管特性的可能性。
關鍵詞:人類疾病 藥物篩選 兒茶酚胺 β-腎上腺素能系統 β受體阻滯劑 血管緊張素受體阻滯劑
簡介:心血管疾病是全球發病率和死亡率的主要原因。盡管心臟藥物已被證明可有效預防和治療心臟功能障礙,但仍在積極尋找改進的療法。心臟毒性仍然是藥物開發過程中失敗的最常見原因。目前用于篩選候選藥物不良心臟癥狀的策略包括體外心肌細胞分析和動物模型的使用。盡管前者可以快速篩查心臟毒性,但它不能反映整個生物體的影響。相反,基于動物的方法允許更詳細地表征心臟毒性,但由于昂貴且耗時的測定,它們的廣泛使用受到限制。因此,開發一個既能降低成本又能保持試驗質量的模型系統對于藥物開發項目的成功至關重要。最近,斑馬魚已成為心血管研究中的一種有價值的工具。即使在胚胎階段,光學透明度和快速發展也可以使個體動物的循環系統可視化。盡管斑馬魚和人類之間的心臟解剖結構存在明顯差異,但一些生理相似性可能使斑馬魚優于常用的嚙齒動物模型。例如,斑馬魚的心跳速度在 120 到 180 次/分之間。這與在健康人中觀察到的大約 70 次/分鐘的靜息心率相當。 嚙齒動物在這方面有很大不同,例如。 鼠心率超過300次/分,大鼠心率范圍為250~493次/分。此外,魚類血管形成的解剖學和分子機制與在人類和其他高等脊椎動物中觀察到的相似。斑馬魚有一個封閉的循環系統,其中血液循環早在受精后 24 小時 (hpf) 就開始了。72 hpf 完成血管的生長 , 背主動脈是貫穿整個軀干的主要胚胎動脈,在胚胎階段開始血流并逐漸增加速度。迄今為止,斑馬魚胚胎已被用于藥物依賴性心臟毒性的評估和心臟保護分子的鑒定。β-腎上腺素能受體(βAR)激動劑(如腎上腺素)、多柔比星和特非那定表現出不同的心臟毒性模式。慢性βAR刺激啟動受體的下調,從而抑制心律和心臟收縮。活性氧(ROS)的產生和心肌細胞死亡的誘導被認為是多柔比星損傷心肌引起危及生命的心肌病的機制。特非那定是一種停用的抗組胺藥,可導致QT間期延長,從而導致心律失常。所有這些藥物的心臟毒性特性已在嚙齒動物模型和人類患者中進行了徹底研究。然而,斑馬魚心臟如何對這些眾所周知的心臟毒性化合物作出反應仍然未知。 據我們所知,這是第一次在斑馬魚模型中對藥物依賴性心臟毒性特征進行正面驗證。 這種平行比較對于將斑馬魚數據進一步臨床轉化至關重要。為了解決這個問題,我們建立了多柔比星、腎上腺素和特非那定誘導的心臟毒性的胚胎斑馬魚模型,并通過功能和形態學改變對其進行了表征。隨后,我們確定了心臟保護藥物——右雷佐生、美托洛爾、卡維地洛和纈沙坦——是否能夠控制斑馬魚的心臟功能障礙。多柔比星、腎上腺素和特非那定的平行比較顯示了化合物特異性的心臟毒性作用,突出了它們不同的作用方式。 進一步的分析表明,β-腎上腺素能和血管緊張素受體拮抗劑可減輕受損的心血管參數。結果證實了斑馬魚模型捕捉藥物心臟毒性和心臟保護特性的可行性。從藥物開發的角度來看,我們的工作為使用快速且價格合理的斑馬魚模型預測受試化合物的心血管特性提供了可能性。
陰性對照組和溶劑對照組的死亡率和自發性畸形不超過10%。為了誘導應用多柔比星、腎上腺素和特非那定的心臟毒性模型,將24 hpf 到 96 hpf 斑馬魚胚胎暴露于化合物 (toxCOI)。心臟保護化合物(protectCOI),即美托洛爾、卡維地洛、纈沙坦和右雷佐生,在心臟毒性化合物(即22 hpf、46 hpf和70 hpf)出現前兩小時使用。根據我們的劑量范圍研究和文獻數據選擇受試心臟保護化合物的濃度。美托洛爾最小抑制心率濃度為250?μM和次有效濃度為100?μM和50?μM。卡維地洛選擇 25、10 和 5 μM 的等效劑量。纈沙坦選擇 200 μM、80 μM 和 40 μM 的非抑制性心率濃度。根據文獻數據,選擇了 200 μM 和 800 μM 劑量的右雷佐生,并驗證它們是無毒的。由于溫度和噪聲的變化,可以觀察到實驗之間的一定變化。 所選濃度的所有四種心臟保護化合物均不會導致死亡或發育遲緩。
多柔比星誘導的心臟毒性:多柔比星的心臟毒性在人類和動物模型中得到了很好的表征。我們進行了初步的劑量和時間范圍研究,以優化治療方案,以實現多柔比星誘導的心臟毒性的可重復發展。在第一次孵育 (hpi) 后,在很寬的濃度范圍內 (50–150 μM) 多柔比星直至 48 h 都沒有引起死亡。在72 hpi時多柔比星誘導的死亡率變得明顯,50%致死濃度(LC50)值為104?μM。不早于 48 hpi 在至少 70 μM 的濃度下觀察到心率抑制。在 72 hpi,抑制心率的最高非致死濃度等于 70 μM。對照組和多柔比星治療組斑馬魚心率的平均絕對差異為-19.97 bpm。除心率抑制外,多柔比星在 72 hpi 導致心臟異常的濃度依賴性發展。 在 70 μM 劑量 (72 hpi) 時,三分之一的暴露仔魚檢測到異常。結構和功能異常包括:心包水腫 (PE)、心臟牽張和血管內缺乏血液循環。此外,多柔比星在大量微血管的區域引起嚴重出血(HE)。由于多柔比星具有熒光,因此我們可以確定其在胃腸道中的分布。于沒有死亡率、顯著的心率抑制和結構性心臟異常的存在,選擇 70 μM 的劑量與假定的心臟保護藥物聯合治療進行進一步評估。
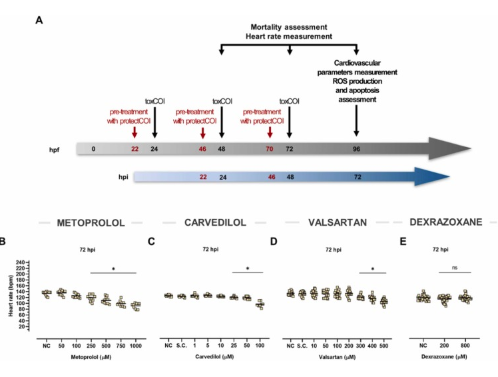
圖1、斑馬魚仔魚心血管效應評估
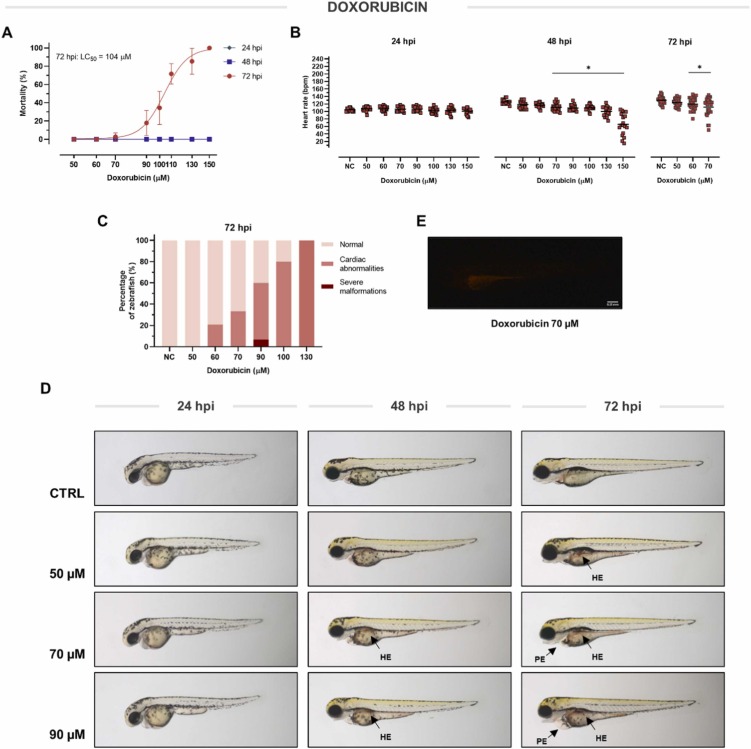
圖2、多柔比星對斑馬魚的毒性和活性。多柔比星對斑馬魚死亡率(A)、心率(B)和形態(C-E)的影響。
腎上腺素誘導的心臟毒性:兒茶酚胺水平過高的心臟毒性效應已在實驗模型和人類心臟中得到充分證明。其中一種內源性兒茶酚胺是腎上腺素——一種腎上腺素能受體的強效刺激劑。因此,我們決定探索腎上腺素暴露對斑馬魚心臟的影響。從 250 μM 開始,腎上腺素以劑量依賴性方式增強心臟功能,模擬其對人體心臟的短效活性。在稍后的時間點,這種效應會導致心率降低。 由于這種抑制作用,在 48 hpi 時恢復到基線。在 72 hpi 時,從 500 μM 的腎上腺素中檢測到明顯的心動過緩。 進一步增加劑量會產生嚴重的心動過緩,在 1000 μM 時達到 ‐19.80 bpm。在這個濃度范圍內,腎上腺素在任何時間點都不會誘發任何形態異常。為了進一步研究,選擇了 1000 μM 的心臟抑制劑量。
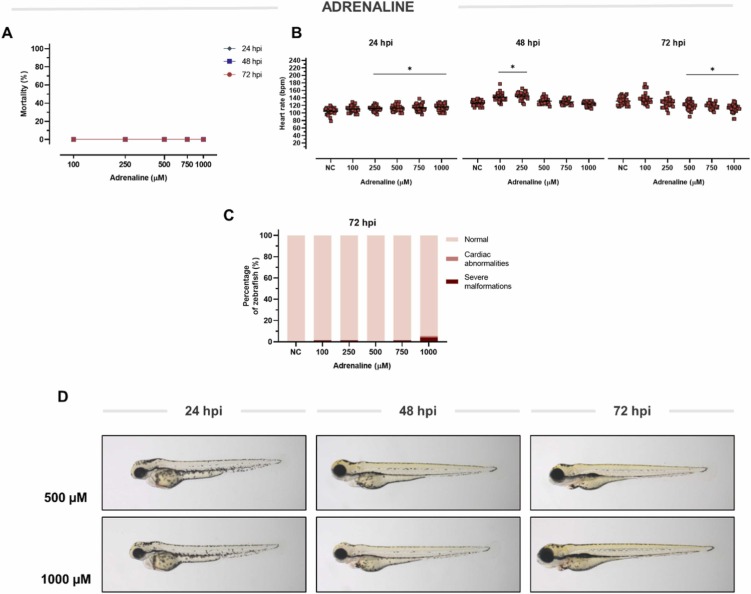
圖 3、腎上腺素對斑馬魚的毒性和活性。
特非那定誘導的心臟毒性:由于特非那定是眾所周知的心臟毒性物質,我們確定它是否反映了斑馬魚仔魚的類似毒性。在這里,特非那定顯示出高毒性,分別在48hpi和72hpi下導致LC50分別為50?μM和39?μM。特非那定從24小時開始以濃度依賴性方式降低心率。此后在 72 hpi 觀察到5 μM 到 25 μM 的心率抑制。暴露于特非那定后,斑馬魚在 72 hpi 的濃度低至 10 μM 時表現出廣泛的心臟異常(概率為 32%)。顯微鏡檢查顯示除心包水腫(PE)外,心室塌陷。當特非那定濃度高于 20 μM 時,檢測到心臟和嚴重的身體畸形,即頭部 (HM) 和尾部改變 (TM) 和卵黃囊水腫 (YSE)。因此,為了進一步研究,選擇了 10 μM 的非致死濃度,因為它的心臟抑制作用發生時沒有可檢測到的嚴重畸形。
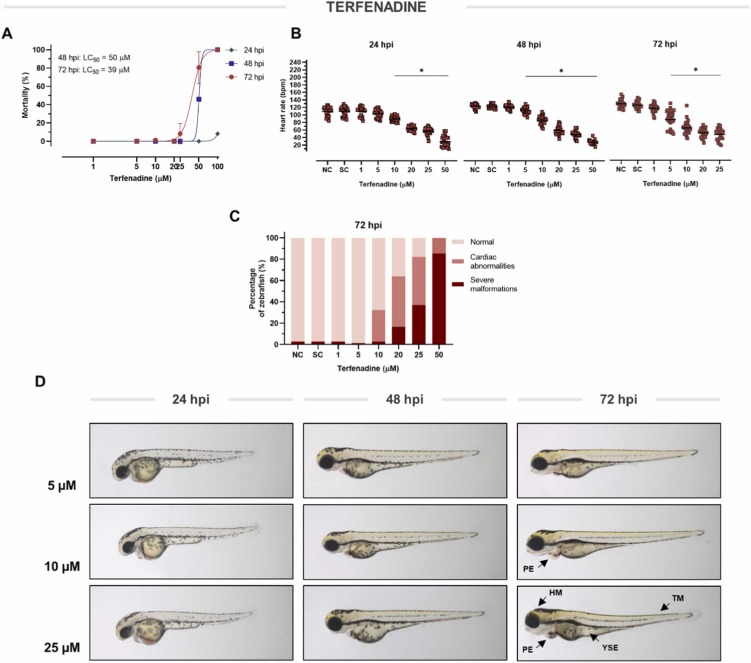
圖 4 特非那定對斑馬魚的毒性和活性。
心臟毒性模型對心臟功能變化的比較:為了進一步驗證暴露于所提出的心臟毒性化合物是否會導致生理性心臟功能和結構缺陷的損害,評估了縮短分數、每搏輸出量和心輸出量。縮短分數從對照動物的 18.50% 顯著降低到多柔比星處理的魚的 9.76%,表明心室收縮力減弱。我們分析了每搏輸出量參數,該參數是指每次心跳后從心室泵出的血液量。 與對照相比,多柔比星顯著減少每搏輸出量約 0.14 nL。除了收縮力降低之外,多柔比星處理的魚的心臟似乎反映了心臟泵血的不規則方式,即心輸出量的改變,這可能表明心肌有缺陷或心力衰竭的癥狀。心臟功能評估概括了腎上腺素不影響任何明顯的表型心臟異常。下一個測試的心臟毒性化合物 - 特非那定 - 增加了心臟的每搏輸出量,表明心臟泵血更加有力或泵血量增加。 該效果與心率抑制有關,而縮短分數未改變。我們推測,隨著心率持續下降,每搏輸出量會因充盈時間增加而增加。 因此,心輸出量保持穩定,因為降低的心率被增加的每搏輸出量所補償。我們比較了所提出的模型與心率的變化,分別測量心臟心房和心室的搏動次數。在測試的化合物中,只有特非那定引起了促心律失常作用,表現為心房早博或額外搏動。 多柔比星消除了心臟收縮的能力和規律的節律,因此抵消了每搏輸出量和心輸出量。腎上腺素僅降低心率,而特非那定引起的心動過緩可補償每搏輸出量的增加。圖5D顯示了經心臟毒性化合物或溶媒對照處理的mnx1:dsRed轉基因斑馬魚仔魚的形態缺陷。多柔比星導致心臟拉長,暴露于特非那定 72 小時后,觀察到心室輕微變形。
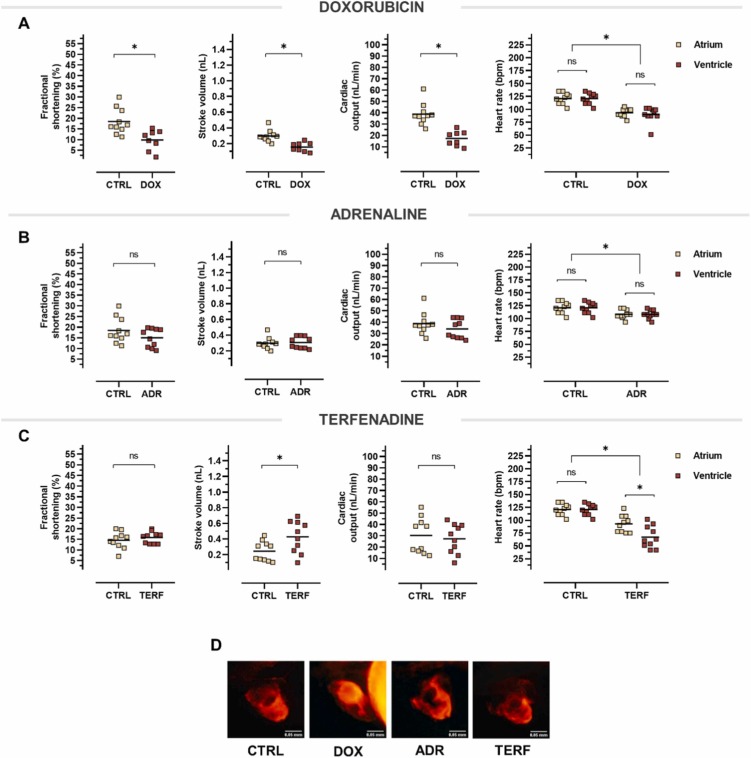
圖 5. 心臟毒性模型對心臟功能變化的比較。
多柔比星具有促氧化作用,而特非那定誘導斑馬魚仔魚凋亡:ROS誘導的氧化應激是引起心臟毒性的主要因素之一,導致細胞凋亡死亡。有鑒于此,我們進行了一組實驗,以提供對斑馬魚模型中多柔比星、腎上腺素和特非那定毒性的機制洞察。如圖6A所示,與對照組相比,僅多柔比星處理的斑馬魚的ROS水平顯著升高。伴隨著在熒光顯微鏡下觀察斑馬魚仔魚,發現心臟區域的熒光強度更高。因此,結果證實了多柔比星提高斑馬魚 ROS 生成的能力。 形成鮮明對比的是,與對照相比,多柔比星治療不影響程序性細胞死亡,腎上腺素在動物中既不引起活性氧的產生也不引起細胞凋亡。下一個評估模型—特非那定—對活性氧的產生沒有影響,但是吖啶橙染色顯示,它誘導心臟區域的細胞死亡。結果表明,特非那定誘導的細胞凋亡不歸因于ROS的形成。
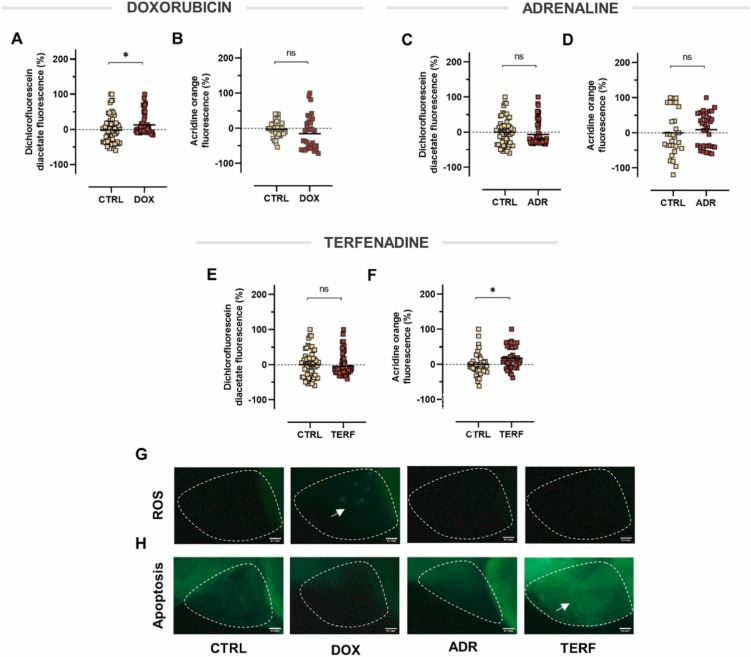
圖6、活性氧生成和凋亡的檢測。
評估化學誘導的心臟保護作用:如上所述,斑馬魚暴露于之前在人類和嚙齒類動物模型中被證明具有心臟毒性的藥物后出現心臟功能障礙。為了進一步驗證斑馬魚作為心血管研究藥理學模型的可用性,我們旨在驗證用于減輕人類心臟功能障礙的藥物的心臟保護活性是否可以在斑馬魚中復制。這三種藥物是根據其治療特點選擇的:美托洛爾(選擇性β1-腎上腺素能受體拮抗劑)、卡維地洛(具有復雜藥理學特征的α1-和β-受體阻滯劑)和纈沙坦(血管緊張素受體阻滯劑)。這些藥物通常用于治療高血壓、心力衰竭、心律失常和心肌病。在多柔比星誘導的毒性背景下,研究了右雷佐生的特性,這是唯一一種臨床批準的用于基于蒽環類藥物的抗癌治療的心臟保護劑。評估了美托洛爾、卡維地洛和纈沙坦對多柔比星、腎上腺素和特非那定誘導的心臟毒性的心臟保護活性。
右雷佐生—唯一經臨床批準的基于多柔比星的心臟毒性藥物—對斑馬魚仔魚有效:早在 24 hpi 時,右雷佐生在 200 μM 和 800 μM 兩種測試劑量下都能減弱多柔比星誘導的心率抑制。在 200 μM 的劑量下,在 48 hpi 時也發現了保護活性,但是,在 72 hpi 時效果并未維持。盡管右雷佐生不能緩解多柔比星引起的血流障礙,但它能夠逆轉多柔比星引起的血管收縮。此外,與單獨使用多柔比星相比,用右雷佐生聯合治療的斑馬魚的心臟異常程度要小得多。因此,已顯示給予右雷佐生可改善多柔比星相關的心臟功能障礙。
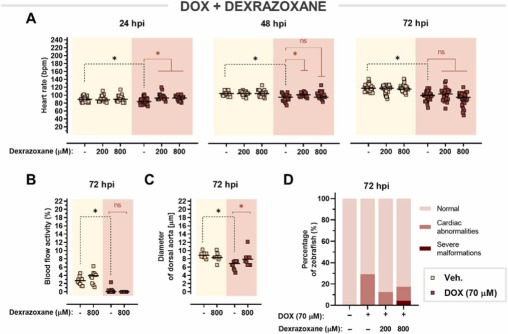
圖 7. 右雷佐生對多柔比星誘導的心臟毒性的心臟保護作用。
美托洛爾對多柔比星誘導的心臟毒性沒有影響:單用多柔比星可顯著降低心率,美托洛爾不能逆轉這種作用。在 72 hpi 時,在多柔比星處理的斑馬魚中觀察到進一步的心率抑制,多柔比星與美托洛爾共同處理甚至加劇了這種效果,在 250 μM 美托洛爾與單用多柔比星相比, 多柔比星誘導的心動過緩與血流減少和背主動脈收縮有關。在這兩種情況下,美托洛爾都無法改善這些影響。美托洛爾并不能阻止多柔比星對心臟的明顯改變,這證實了美托洛爾不能預防多柔比星引起的心臟毒性。
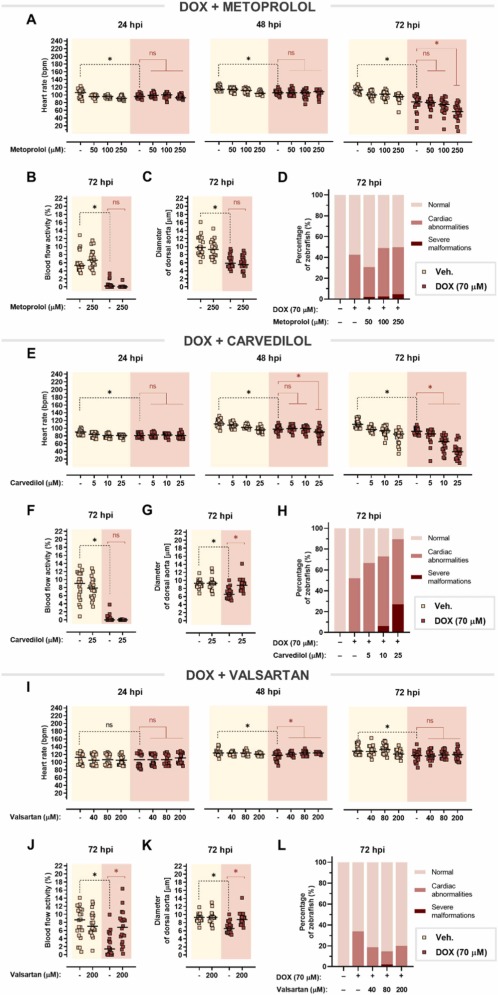
圖 8. 對多柔比星誘導的心臟毒性的心臟保護作用。
卡維地洛僅減輕多柔比星誘導的血管收縮:多柔比星和卡維地洛的共同治療加劇了多柔比星誘導的心率抑制,尤其是在 72 hpi。卡維地洛沒有改善血流受損,但它能夠逆轉多柔比星引起的血管收縮。單獨使用多柔比星會導致心臟異常,例如心包水腫和心臟拉長,卡維地洛甚至以明顯的濃度依賴性方式增強了這種作用。因此,卡維地洛不能預防多柔比星引起的心臟毒性。
β-腎上腺素能系統對斑馬魚仔魚的藥理反應是保守的:美托洛爾和卡維地洛屬于競爭性β-腎上腺素受體拮抗劑,可阻斷內源性兒茶酚胺——腎上腺素和去甲腎上腺素。在這里,兩種β受體阻滯劑都能逐漸逆轉在24 hpi時觀察到的腎上腺素誘發的心動過速。進一步暴露于腎上腺素導致心率和血流量在72 hpi時下降。盡管美托洛爾和卡維地洛都增強了腎上腺素引起的心率抑制,但這些藥物顯著改善了腎上腺素引起的血流量減少。所有測試的 β-腎上腺素能配體均不影響背主動脈的直徑。
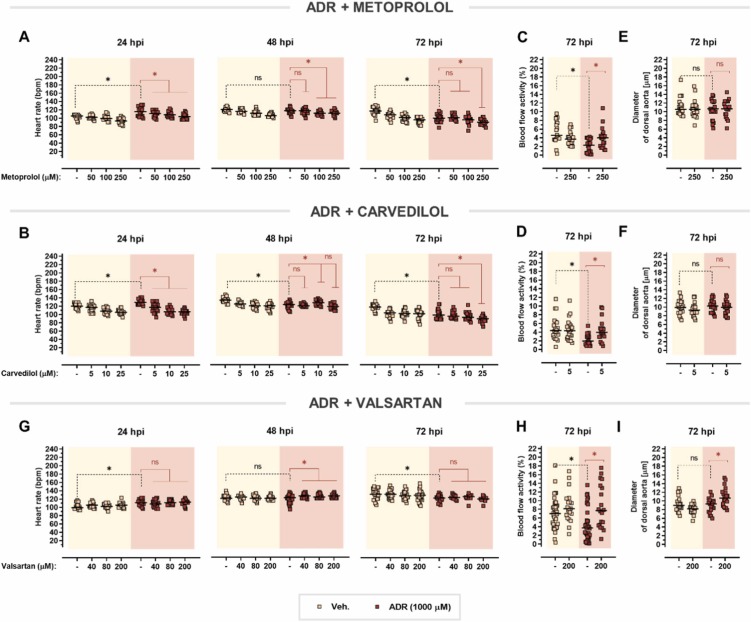
圖 9. 對腎上腺素誘導的心臟毒性的心臟保護作用。
纈沙坦完全減輕特非那定引起的心臟毒性:美托洛爾在治療特非那定引起的心律失常、血流和血管收縮方面的心臟毒性方面沒有顯著改善。此外,特非那定單獨使用時,患有心臟異常的斑馬魚仔魚的比例相當高,與美托洛爾聯合使用并不能以明顯的劑量依賴性方式改善這種效果。下一個評估的藥物——卡維地洛——甚至在 72 hpi 時加劇了特非那定誘導的心動過緩的心率下降。盡管卡維地洛在控制血流受損方面失敗,但它消除了血管收縮,并略微降低了由特非那定引起的心臟異常的發生頻率。因此,與美托洛爾相比,卡維地洛在改善特非那定心臟毒性方面更有效。有趣的是,纈沙坦在所有時間點逐漸改善心動過緩,與 72 hpi 單獨使用特非那定相比,在 200 μM 時心率甚至增加約 +19 bpm。纈沙坦改善了受損的血流,并且與背主動脈擴張相吻合。
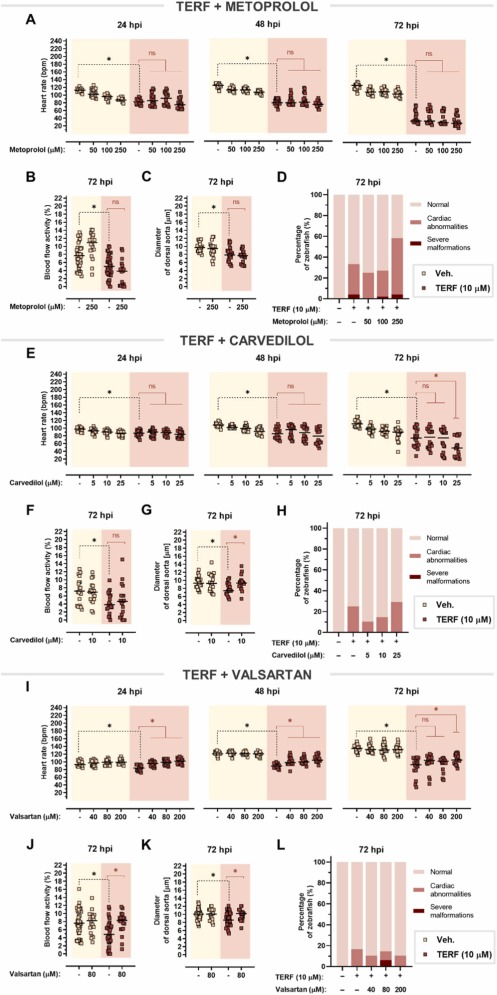
圖10、特非那定引起的心臟毒性的心臟保護作用。
在這項研究中,我們全面評估了斑馬魚心臟毒性和心臟保護的藥理模型,我們的結果表明:多柔比星、腎上腺素和特非那定在魚類中引起明顯的心臟毒性跡象;多柔比星引起心肌損傷,腎上腺素暴露導致最初的心動過速,隨后心率下降,而特非那定引起促心律失常;暴露于多柔比星和特非那定分別導致 ROS 過度產生和細胞凋亡;阻斷腎素-血管緊張素系統,以及在較小程度上阻斷β-腎上腺素能系統,改善了斑馬魚藥物依賴性心臟功能障礙;斑馬魚模型反映了β-腎上腺素能和血管緊張素系統的藥理學反應。工作的關鍵新穎方面是對斑馬魚中三個特征明確的心臟毒性模型進行平行比較和驗證。此外,我們設計了一種方法,可以在藥物開發的早期階段評估心血管效應。 我們獲得的結果表明斑馬魚仔魚可以表現出心臟毒性的基本癥狀,因此適用于大規模測試化合物對心臟的影響。這里開發的方案快速(只有三天的時間進行完整評估),成本效益高,適用于自動化高通量心血管篩查。綜上所述,這些實驗的結果為斑馬魚對心血管藥物的功能性反應提供了見解,斑馬魚模擬了人類的反應,因此支持斑馬魚模型在心血管疾病研究中的價值。
原文出自:Pharmacological assessment of zebrafish-based cardiotoxicity models - ScienceDirect




 17312606166
17312606166