聽說,憋氣30秒,可以鑒定你的肺是否健康。
快來檢測一下!現在,開始憋氣,直到圓點從A點抵達B點。

(圖片來自網絡)
什么?沒有堅持到30秒!
那我很遺憾的告訴您,這個結果并不能真實反映您的肺部健康狀況(頂鍋跑)~只能說明,您的肺活量較小,是不是好久沒運動啦?
雖然這一測試無法判定肺的健康狀況,但你是否感受到了呼吸的重要性。每時每刻,新鮮的空氣正通過氣管進入溫暖的胸腔,其中的氧氣從肺中濾出,隨著血液奔向大腦,四肢…
今天,我們便來介紹下人體呼吸中樞——肺,主要包括它的結構,細胞類型,相關重大疾病及動物模型。
肺的生理結構
正常的肺呈淺紅色,位于胸腔,覆蓋在心臟之上。左右胸腔各有肺葉,左二右三,右肺可以分為上、中、下三葉,左肺則僅有上、下兩葉,所以人體的肺一共有五葉。每個肺葉之間有胸膜隔開,各自有支氣管與主氣管相通,彼此之間沒有聯系。
每次呼吸,空氣通過鼻腔進入氣管,再進入支氣管。支氣管分為左右主干支氣管,其組成與氣管相似,并逐漸分枝成更小的分支——氣管支氣管樹,對吸入的空氣進行引導、加濕和加熱。終末支氣管最后形成小肺泡簇,肺泡總數達到數百萬。肺泡被毛細血管網所包圍。通過毛細血管的薄膜,空氣和血液進行氧氣和二氧化碳的交換[1]。
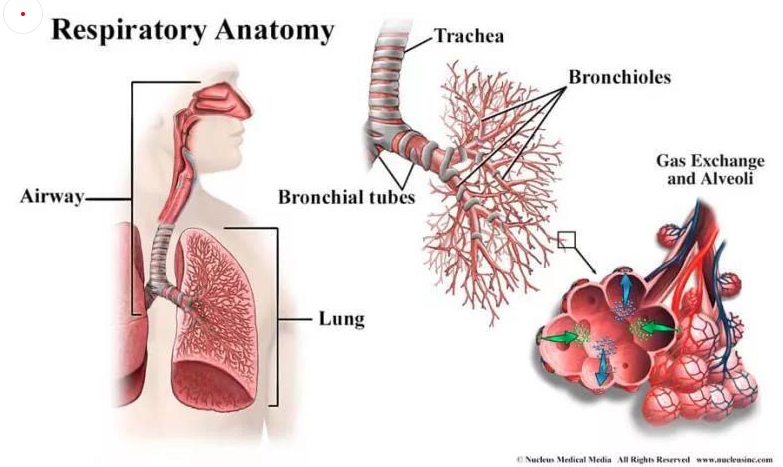
圖1 呼吸系統示意圖(引自https://www.nhlbi.nih.gov/health-topics/how-lungs-work)
肺的細胞分型
肺部細胞是肺執行生理功能的基本單位,通過了解其種類和狀態,人們可以進一步研究肺部疾病的發生機理,進行精確有效的治療。通過顯微鏡觀察,免疫熒光標記等傳統方法,已知曉的人體肺部細胞類型有45種。而科學家借助剛剛興起的單細胞測序技術,從另一個維度繪制出人體更多的肺部細胞種類及表達狀態,確定了成人肺中有58種轉錄上不同的細胞群體,包括15種上皮細胞,9種內皮細胞,9種基質細胞(圖2)和25種免疫細胞(圖3)[2]。
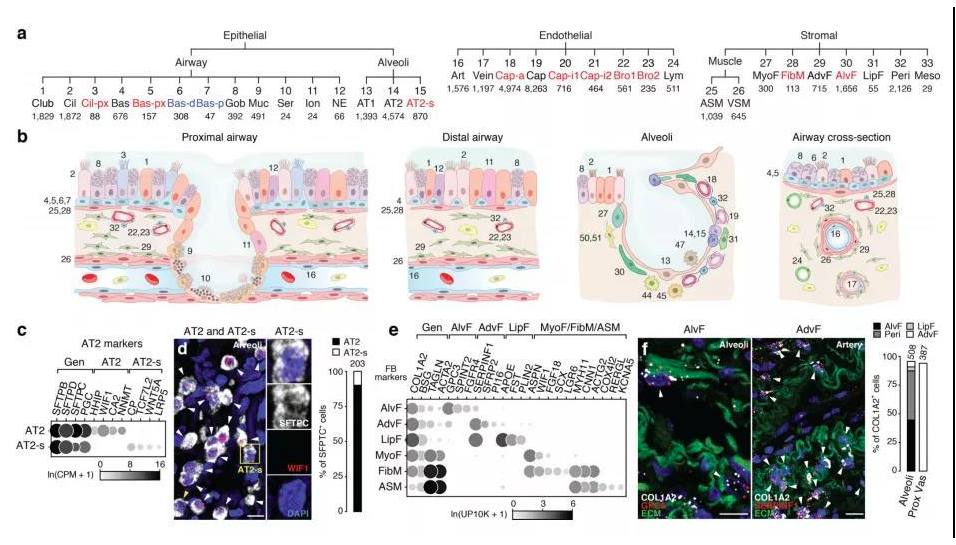
圖2 肺部上皮細胞、內皮細胞和基質細胞群分類及組織學定位[2]
而歸納出的這58種細胞中包含41種已知的肺部細胞類群,不包含原本被認為存在的4種細胞,即神經元、神經膠質,簇狀細胞以及嗜酸粒細胞。對該研究結果感興趣的小伙伴可以在公眾號中索要原文。下面將挑選兩大類含量最多的肺部細胞(上皮細胞和內皮細胞)做簡要介紹。

圖3 肺免疫細胞分群[2]
肺泡上皮細胞
肺泡上皮細胞作為氣體交換的單位(圖4),維持著肺臟的基本功能。肺泡上皮細胞主要由I型肺泡上皮細胞,Ⅱ型肺泡上皮細胞組成。
肺泡I型細胞,其表面標志物是水通道蛋白5(AQP5)占肺泡表面積的96%。這些細胞非常薄,呈鱗狀,它們與肺毛細血管內皮共用一個基底膜,形成氣血屏障,在此發生氣體交換。
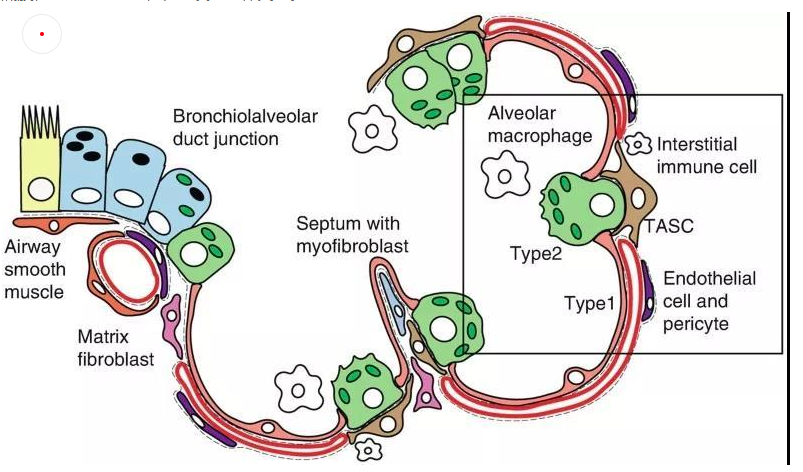
圖4 小鼠肺泡區示意圖[4]
II型細胞為球形肺細胞,其表面標志物為SFTPC(又稱為SPC),僅占肺泡表面積的4%,但占肺泡上皮細胞的60%,占全部肺細胞的10-15%。Ⅱ型肺泡細胞位于肺泡拐角處,具有合成、分泌肺表面活性物質的功能,還可調節肺泡水分,兼有分化成I型細胞的作用[3]。
肺部內皮細胞
內皮細胞位于滲透在肺部的血管上,它不僅是血液,空氣和基質組織之間的物理屏障,還具有代謝活性,參與炎癥控制、白細胞運輸、血管生成和血管張力等過程。根據最新的單細胞測序結果,肺臟內皮細胞可分為淋巴內皮細胞、動脈內皮細胞、普通毛細血管內皮細胞(General capillary, gCap )、氣管細胞(Aerocyte)、肺靜脈內皮細胞和全身靜脈內皮細胞[5]。
其中,參與氣體交換的是肺泡毛細血管內皮細胞,由“氣管細胞”和普通毛細血管內皮細胞共同組成。“氣管細胞”專門用于氣體交換和白細胞運輸,是肺獨有的內皮細胞;普通毛細血管內皮細胞用于調節血管舒縮張力,并在毛細血管穩態和修復中充當干細胞/祖細胞(圖5)[6]。
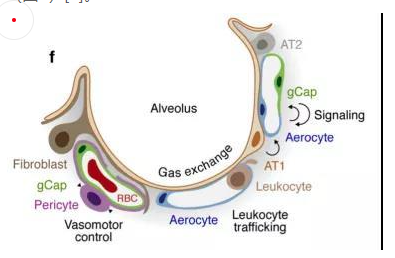
圖5 肺泡氣體交換示意圖[6]
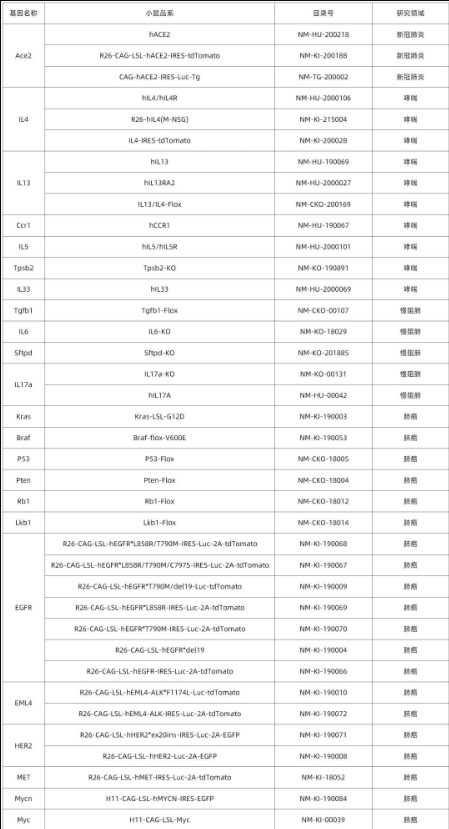
南模生物在小鼠肺部細胞特定marker基因中敲入Cre/Dre重組酶元件或報告基因,研究者可以對每類細胞進行標記,還可以在特定細胞群里進行基因及細胞功能的研究。具體模型信息見下表:
表1 肺部特定細胞工具鼠
作為重要的呼吸器官,肺部隨時會侵入細菌、病毒、真菌、塵埃等,造成不同類型的肺部疾病,如新冠肺炎,大葉性肺炎,支氣管炎等,嚴重的可導致急性或慢性呼吸衰竭及各類肺癌。目前,人們對這些疾病發病機制還不夠了解,因此治療措施十分缺乏。為深入研究疾病的發生發展,相關研究動物模型的構建是必不可少的一環。
新冠肺炎研究模型
自新冠疫情爆發以來,截至2021年11月8日,全球新冠肺炎累計確診病例已經超過2.5億例,全球累計死亡病例超過505萬例。
ACE2 是此次新冠病毒感染人體的主要結合受體。新冠病毒的刺突糖蛋白可以與肺上皮細胞細胞膜上的 ACE2特異性的結合。通過脂質胞膜的內吞作用,病毒顆粒與囊泡融合并快速進入宿主細胞內[7]。但小鼠細胞不具有結合新冠病毒蛋白的能力,因此可以將人ACE2的轉入到小鼠體內,這種小鼠感染SARS-CoV-2后的腸道、肺炎癥狀及病理學特征與COVID-19患者很相似[8]。南模生物自主研發了CAG-hACE2-IRES-Luc-Tg(hACE2-Tg) 小鼠,可以作為疫苗和藥物研發的重要工具。詳細介紹可見往期推文:傳染病研究殺手锏——常用動物模型介紹
慢性阻塞性肺炎研究模型
慢性阻塞性肺炎(chronic obstructive pulmonary emphysema,COPD)又稱阻塞性肺氣腫,具有終末細支氣管遠端部分(包括呼吸性細支氣管、肺泡管、 肺泡囊和肺泡)膨脹,并伴有氣腔壁的破壞的表現。目前,我國慢阻肺患者人數約1億,已經成為與高血壓、糖尿病“等量齊觀”的慢性疾病,構成重大疾病負擔[9]。
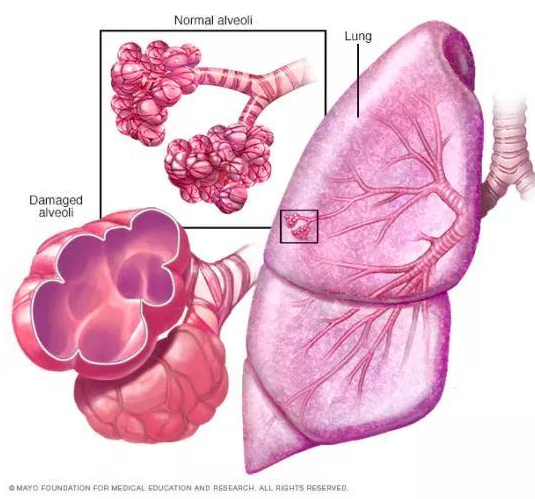
圖6 正常的肺泡和損傷后的肺泡對比圖,損傷后的肺泡失去彈性并過度膨脹(圖片來自網絡)
常規COPD誘導模型
目前最常用的COPD動物模型是小鼠。通過在香煙煙霧中暴露 6個月,小鼠顯示出人類COPD的一些特征,如慢性肺部炎癥、中度氣道擴增和輕度小氣道纖維化[10]。此外,通過彈性蛋白酶進行氣管滴注、微生物及其產物誘導或者其他化學物質誘導,也有構建成功的先例[11]。
基因修飾COPD自發模型
隨著基因修飾技術的發展,通過調控COPD相關基因的表達,建立基因工程小鼠模型的應用呈上升趨勢。表面活性劑蛋白(Surfactant protein, SP)-D是一種模式識別分子,屬于膠原凝集素蛋白家族。SP-D的主要功能是結合病原微生物或者寄生蟲,這些生物通過調理作用被中性粒細胞清除,從而被吞噬細胞識別。臨床中發現具有較高的SP-D水平的患者,其因COPD產生的風險較低,肺功能下降速度較緩慢。Sftpd基因(編碼SP-D蛋白)敲除小鼠可出現肺氣腫、進行性隔膜壁厚度和胸膜下纖維化,提示這些動物出現肺內肺氣腫和纖維化的聯合表型[12]。
COPD靶點研究模型
IL-17a是COPD中性粒細胞氣道炎癥的關鍵介質。升高的血清IL-1β和 IL-17a水平可作為COPD持續性中性粒細胞氣道炎癥和潛在持續惡化的生物標志物。阻斷IL17a/IL17RA可有效降低香煙煙霧誘導的MUC5AC蛋白、IL6、TNFα和IL-1β等炎癥因子在支氣管上皮細胞中的表達。在小鼠體內特異性敲除IL17a則有益于減少中性粒細胞向氣道的募集[13]。這些結果提示靶向IL17a是潛在的COPD治療手段。
COPD患者除了明顯的肺部特征之外,還存在體重減輕的狀況。臨床上發現,COPD患者的痰液和血清中的白細胞介素-6 (IL-6)水平較高。因此,科學家通過構建IL6敲除小鼠,與野生型進行對比,驗證IL6對COPD疾病發生的影響。研究結果發現,野生型小鼠和 IL6敲除小鼠同時進行香煙煙霧暴露,IL6敲除小鼠具有較低的體重,血清瘦素水平和脂肪組織質量,提示IL-6可作為體重的調節因子[14]。
南模生物可提供COPD相關基因及治療靶點敲除小鼠和人源化小鼠,助力COPD相關研究(見文末表3)。
哮喘研究模型
哮喘又名支氣管哮喘。支氣管哮喘是由多種細胞及細胞組分參與的慢性氣道炎癥。目前對哮喘的根本病因尚不能完全了解。罹患哮喘的最大風險因素是遺傳易感性與環境接觸(吸入可能誘發過敏反應或刺激氣道的物質和顆粒)二者的結合,這類物質和顆粒包括室內過敏源(例如家庭塵螨)、室外過敏源(例如花粉)和煙草煙霧等[15]。
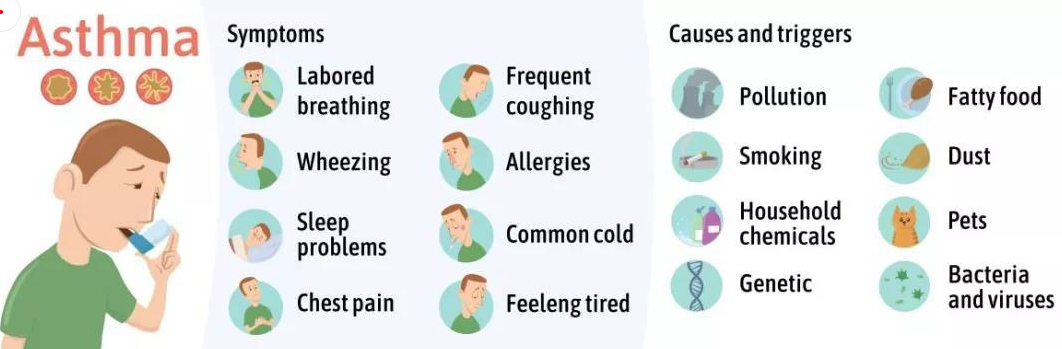
圖7 哮喘產生的癥狀和致敏源
塵螨(HDM)是屋塵過敏的主要過敏源。在已有的研究中證明了塵螨在哮喘的發展中及誘發其他過敏性疾病(如皮炎和鼻炎)中起重要作用[16]。HDM的糞便顆粒中含有多種過敏原,這些過敏原是全世界過敏性哮喘的主要誘因,可通過局部使用HDM開發具有臨床相關意義的小鼠模型。南模生物可提供塵螨誘導的哮喘模型,詳細驗證數據如下。圖1為野生型C57BL/6小鼠經塵螨誘導后免疫細胞數量變化的結果,對照組小鼠相比,中心粒細胞、淋巴細胞和嗜酸性細胞的數量有明顯的增加。
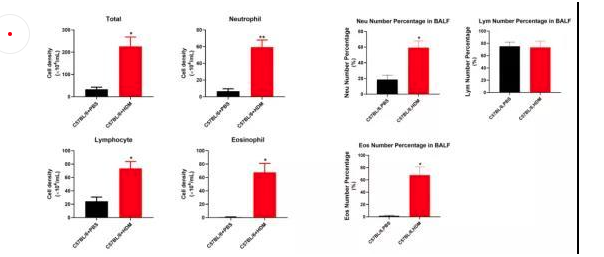
圖8 C57BL/6小鼠在塵螨誘導后各類免疫細胞數量的變化
絕大多數哮喘患者發作時可通過抗炎、平喘等傳統治療藥物得到控制,但仍有部分患者的病情需要借助全身應用高劑量激素才可緩解或仍無法控制,甚至威脅生命。近年來,針對這些難治性重癥哮喘,人們開發了新的靶向藥物并應用于臨床。目前已上市的靶向藥有奧馬珠單抗(抗IgE),IL-5/IL-5R單抗。高潛力在研的重度哮喘藥物有IL-4/IL-13單抗;TSLP抗體;IL-33/ST-2單抗等。南模生物可提供相應靶點的人源化小鼠,助力靶向創新藥物的研發和篩選(見文末表3)。
肺癌研究模型
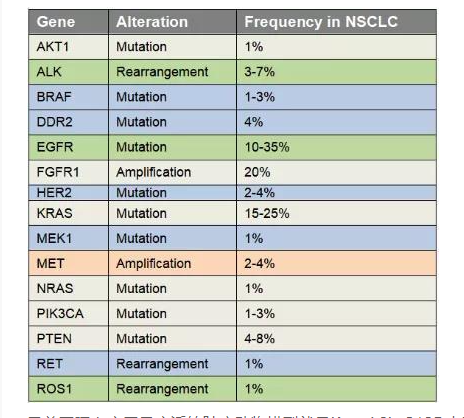
肺癌是起源于上皮組織的惡性腫瘤,在我國各種惡性腫瘤中發病率和死亡率均排名第一,好發年齡在70歲以上,男女發病率之比為2:1。由于空氣污染、放射性暴露以及肺部真菌感染等原因,使得肺癌的發病率和死亡率久居不下。肺癌主要分為非小細胞肺癌(non small cell lung cancer, NSCLC)和小細胞肺癌(small celllung cancer, SCLC),其中非小細胞肺癌約占肺癌的80~85%[17]。在非小細胞肺癌中,發現很多驅動突變,常見的驅動突變包括Kras突變、EGFR突變、FGFR1擴增、ALK重排、HER2突變、MET擴增、BRAF突變等[17]。研究人員對肺癌的多個突變進行探究,將肺癌中發現的突變進入引入到小鼠中,從而獲得多種用于研究肺癌發生與轉移機制、篩選和評價抗腫瘤藥物的肺癌模型。
表2 非小細胞肺癌中基因突變頻率和類型[17]
目前國際上應用最廣泛的肺癌動物模型就是Kras-LSL-G12D小鼠模型,可以通過與肺上皮細胞特異性的Cre轉基因小鼠雜交來實現Kras突變體的激活,從而導致肺癌的發生。南模生物提供的Kras(LSL-G12D/+)小鼠品系在Kras突變基因的上游插入了loxp-stop-loxp終止序列,其在沒有cre重組酶的條件下是不表達的。Cre介導的重組可去除終止密碼子,使致癌基因表達。采用腺病毒載體攜帶Cre感染肺部細胞后,導致肺腫瘤發生的頻率非常高(圖8)。
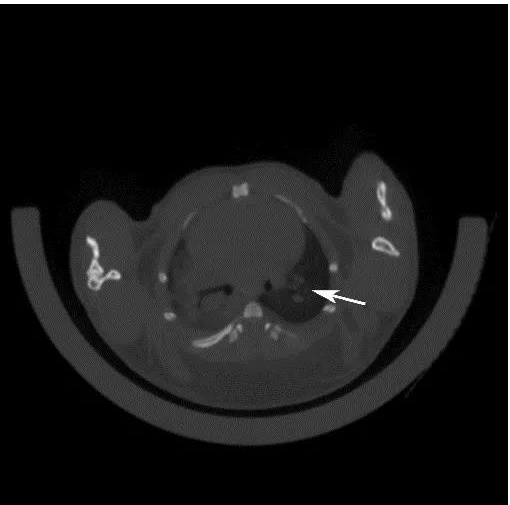
圖9 采用氣管內注射的方法,將AAV-cre病毒注射到小鼠肺部,3個月后對小鼠肺部進行CT檢測,CT結果顯示有明顯的腫瘤的形成。
此外,我們還可以提供Kras(LSL-G12D/+)小鼠腫瘤細胞來源的同系荷瘤小鼠模型。腫瘤細胞可在受體小鼠體內快速增殖(如圖9)。荷瘤小鼠模型可提高臨床藥效評價實驗操作的簡便性。
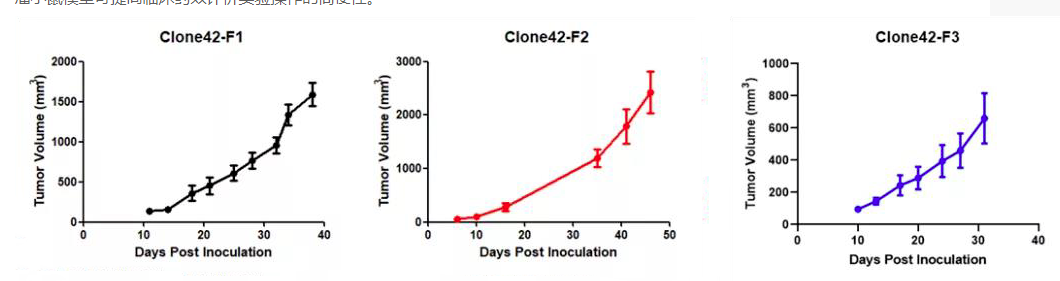
圖10 荷瘤小鼠體內腫瘤細胞體積隨時間增長的變化
關于肺癌的詳細介紹可見往期推文:基因工程小鼠疾病模型系列——肺癌篇
南模生物肺病動物模型
南模生物自主構建了多種基因修飾小鼠(表3),可以用于新冠肺炎、慢性阻塞性肺炎、哮喘、肺癌等疾病的研究和藥物篩選。
表3 肺部疾病相關動物模型列表
南模生物深耕基因編輯領域,提供全方位模式生物服務,包括基因修飾成品模型供應、個性化模型定制、飼養繁育、表型分析、藥效評價等,滿足不同實驗室需求。
Reference:
[1] https://www.nhlbi.nih.gov/health-topics/how-lungs-work
[2] Travaglini KJ, Nabhan AN, Penland L, et al. A molecular cell atlas of the human lung from single-cell RNA sequencing. Nature. 2020 Nov;587(7835):619-625.
[3] https://www.ncbi.nlm.nih.gov/books/NBK557542/
[4] Hogan B.L.M. (2020) The Alveolar Stem Cell Niche of the Mammalian Lung. In: Nakanishi T., Baldwin H., Fineman J., Yamagishi H. (eds) Molecular Mechanism of Congenital Heart Disease and Pulmonary Hypertension. Springer, Singapore. https://doi.org/10.1007/978-981-15-1185-1_2
[5] Schupp JC, Adams TS, Cosme C Jr, et al. Integrated Single-Cell Atlas of Endothelial Cells of the Human Lung. Circulation. 2021 Jul 27;144(4):286-302. doi: 10.1161/CIRCULATIONAHA.120.052318.
[6]Gillich A, Zhang F, Farmer CG, Travaglini KJ, Tan SY, Gu M, Zhou B, Feinstein JA, Krasnow MA, Metzger RJ. Capillary cell-type specialization in the alveolus. Nature. 2020 Oct;586(7831):785-789. doi: 10.1038/s41586-020-2822-7.
[7] Bohn MK, Hall A, Sepiashvili L, Jung B, Steele S, Adeli K. Pathophysiology of COVID-19: Mechanisms Underlying Disease Severity and Progression. Physiology (Bethesda). 2020 Sep 1;35(5):288-301.
[8] Jiang RD, Liu MQ, Chen Y, et al. Pathogenesis of SARS-CoV-2 in Transgenic Mice Expressing Human Angiotensin-Converting Enzyme 2. Cell. 2020 Jul 9;182(1):50-58.e8.
[9]Wang C, Xu J, Yang L, Xu Y, et al; China Pulmonary Health Study Group. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study. Lancet. 2018 Apr 28;391(10131):1706-1717.
[10]Churg A, Cosio M, Wright JL. Mechanisms of cigarette smoke-induced COPD: insights from animal models[ J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(4): L612-L631.
[11]李麗球, 謝麗華, 孫圣華. 慢性阻塞性肺疾病動物模型的研究進展[J]. 中南大學學報:醫學版, 2017, 42(9):6.
[12] Barreiro E, Wang X, Tang J. COPD: preclinical models and emerging therapeutic targets. Expert Opin Ther Targets. 2019 Oct;23(10):829-838. doi: 10.1080/14728222.2019.1667976. Epub 2019 Sep 20. PMID: 31512957.
[13] Wu M, Lai T, Jing D,et al. Epithelium-derived IL17A Promotes Cigarette Smoke-induced Inflammation and Mucus Hyperproduction. Am J Respir Cell Mol Biol. 2021 Jun 29.
[14] Pauwels NS, Bracke KR, Maes T, et al. The role of interleukin-6 in pulmonary and systemic manifestations in a murine model of chronic obstructive pulmonary disease. Exp Lung Res. 2010 Oct;36(8):469-83.
[15]https://www.who.int/zh/news-room/fact-sheets/detail/asthma
[16]Tang W, Dong M, Teng F, Cui J, Zhu X, Wang W, Wuniqiemu T, Qin J, Yi L, Wang S, Dong J, Wei Y. Environmental allergens house dust mite-induced asthma is associated with ferroptosis in the lungs. Exp Ther Med. 2021 Dec;22(6):1483.
[17]Min-chul Kwon, Anton Berns. Mouse models for lung cancer. MOLECULAR ONCOLOGY 7 (2013) 165e177.





 17312606166
17312606166