前言
許多進入臨床應用或臨床試驗的藥物都起源于斑馬魚,然而至今為止,這種小動物卻鮮有人知。由于斑馬魚的疾病特征、病因和進展以及分子機制與臨床相關且高度保守,斑馬魚在發育生物學方面的貢獻已得到公認,并已成為人類疾病的一個強有力的臨床前模型。在生理相關劑量范圍內,斑馬魚對藥物分子的反應與人類高度一致,復雜的基因編輯技術加上實時高分辨率成像可以觀察到藥物分子在斑馬魚疾病模型中前所未有的分子細節。至關重要的是,以斑馬魚為模型的疾病通常代表人類疾病的真實模型,可捕捉疾病的病因、進展和解決過程。以此用來進行活體藥物篩選、藥理藥效評價、安全性評價和藥物代謝動力學非常高效且成本低廉。斑馬魚模型在國外已經被多家大型制藥企業廣泛使用于早期藥物發現。在此我們將討論斑馬魚如何成為藥物發現的重要模型以及在醫學發現中斑馬魚的巨大商業化潛力。
斑馬魚(Danio rerio)因其身上的條紋而得名,是小型(2-5厘米)熱帶淡水魚,生活在亞洲南部的河流中。40年前,斑馬魚作為發育生物學模式動物進入了實驗室環境。斑馬魚與人類基因同源性達87%(小鼠與人類基因同源性為90%),由于其具有易飼養、繁殖力強、發育快、受精卵透明易觀察等特點,現已成為在全世界范圍內被廣泛應用的脊椎實驗動物。
復雜的基因編輯加上實時高分辨率成像,可以前所未有的分子細節和分辨率對疾病發展過程進行捕捉以及疾病的建模。至關重要的是,對斑馬魚進行精確的基因編輯可以生成人類疾病等位基因的模型,在斑馬魚身上建模的疾病通常代表了人類疾病的真實模型,捕捉了疾病的病因學、進展和解決過程,廣泛應用于各種癌癥、遺傳病、肝臟疾病、心腦血管疾病、血液疾病、心臟病、行為障礙、中樞神經系統疾病等等。
人類和斑馬魚之間的疾病蛋白和發病過程是保守的,這意味著在人體內發揮活性的藥物分子通常在斑馬魚體內有相同的靶標,特別是與靶蛋白活性區域相互作用的藥物,這在針對癌癥以及遺傳病途徑設計的藥物中尤其顯著,比如MEK抑制劑等靶向療法;以及日常常備藥物如對乙酰氨基酚、5 -羥色胺調節劑;當然,也存在在斑馬魚體內有效但在人體內無效或者在人體內有效但在斑馬魚中無效的現象,這需要在藥物發現階段運用多個模型互相驗證。但總的來說,在斑馬魚體內呈現生物活性的藥物分子在小鼠和人體系統中也具有同樣的藥物特性。最近,小分子藥物篩選除了在胚胎時期進行,也已經在成年魚身上大規模進行,體內篩選的能力加上表型與人類疾病的相關性,使斑馬魚成為全動物化學遺傳學和藥物發現的主要模式動物。
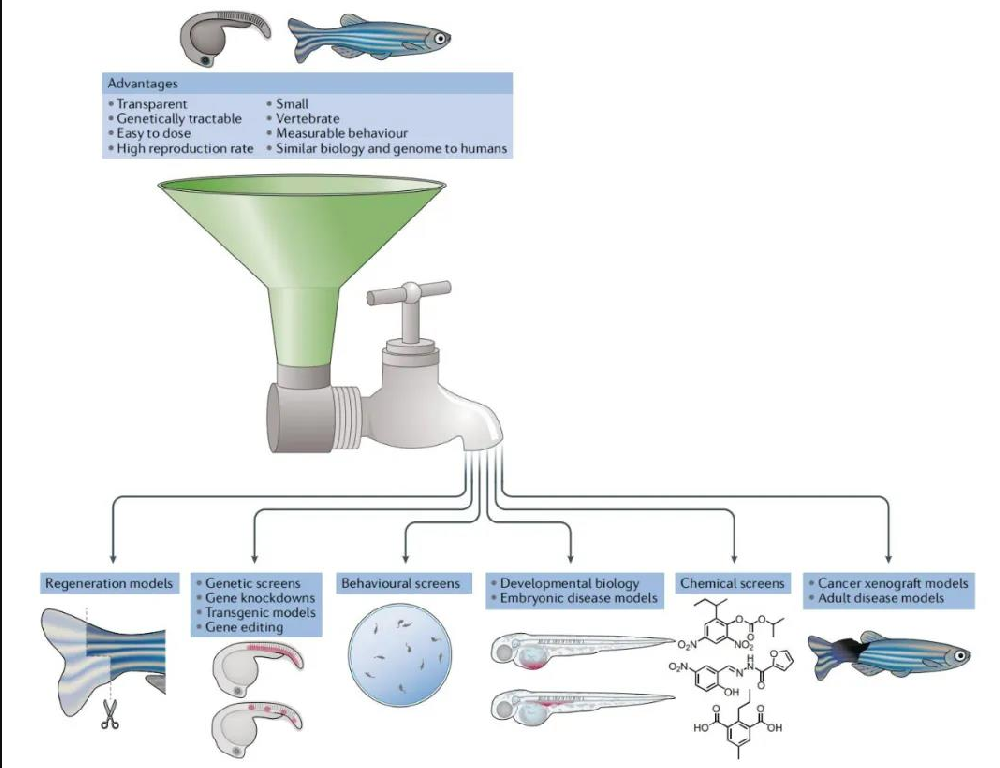
斑馬魚作為模型系統的優點可以應用于胚胎和成年階段的人類疾病和藥物治療模型。數百個透明的斑馬魚胚胎很容易進行基因編輯、轉基因和藥物篩選。在這些胚胎階段,器官和組織的生物學功能可以遵循活體動物的單細胞分辨率,以研究各種復雜的過程,包括發育生物學、發育疾病模型、干細胞和再生、神經回路和行為。
這篇發表于Nat Rev Drug Discov的綜述由愛丁堡大學、哈佛大學、麻省綜合研究所、麻省總醫院、哈佛干細胞研究所聯袂推出,討論了利用斑馬魚建立疾病模型的最新進展,強調了這種模式動物在藥物發現、探索藥物機制方面的潛力和作為臨床前藥物的全動物模型的實用性。
一、斑馬魚表型藥物篩選
藥物發現的一個基本挑戰是顯示其有效性和理解在活體全動物系統中的作用機制。盡管許多化合物和藥物先導藥物在體外篩選或細胞系統中都有活性, 但到了人體則失敗率極高,可見體外篩選有非常大的偏差。藥物發現成功率51%,臨床前研究成功率31.8%,進入臨床則成功率陡降至19.3%,現有的體外篩選模型在人體上的療效或安全性不佳導致藥物研發失敗(數據來源:觀研天下),致使藥物研發長周期、高風險、高投入。
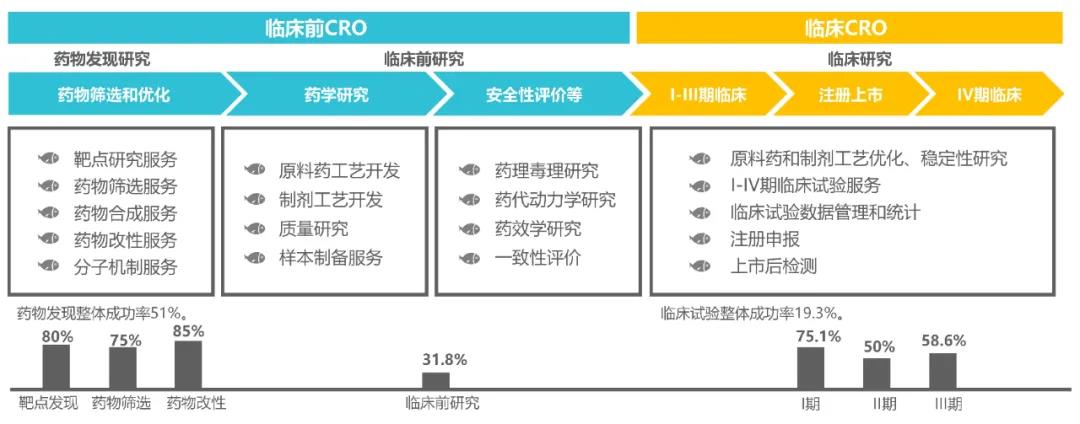
斑馬魚模型是藥物發現“體內篩選”模式動物,在快速提供精準藥效、藥理結果的同時,在初篩階段即可對先導化合物的吸收、分布、代謝、毒性進行早期評價,實現“早期失敗,早期淘汰”,避免將可能失敗的候選藥物帶入后期研發,極大地節省了時間和成本。
通過斑馬魚模型可了解藥物在器官、組織和身體遠端部位疾病的背景下如何發揮作用,在疾病發生和治療階段監測藥理反應,并評估藥物引起的不良反應。
01 斑馬魚模式動物的表型分析
表型藥物篩選是藥物發現的歷史基礎,隨著靶向藥物發現的成功,表型藥物篩選再次出現。表型篩選過程的內在特征包括:即使藥物或先導化合物通過靶向多個靶點產生了預期的表型結果,它們也可以被斑馬魚模式動物識別。例如,激酶抑制劑可以通過靶向多種激酶產生治療效果。
斑馬魚胚胎的小尺寸意味著可以篩選成千上萬的活體胚胎的表型效應,盡管表型斑馬魚篩選方法不如細胞、酵母或酶體外活性測試的通量高,但斑馬魚胚胎的篩選規模遠遠超過所有其他脊椎動物系統中可用的規模。小分子化合物能被斑馬魚胚胎從水中直接吸收、通過鰓被成魚吸收、或者灌胃給藥吸收。
大多數體外高通量藥物篩選的目標是確定具有單一靶點的高選擇性藥物,然而,許多藥物作用于多個靶點,影響多個生物學途徑。藥物或小分子與多個靶點結合的能力——多向藥理學,正被納入藥物設計,以有目的地開發針對“協同靶點組合”的藥物。例如用于治療II型多發性內分泌瘤的AD57,就是一個具備多向藥理學特性的抗癌候選藥物。II型多發性內分泌瘤是由激活編碼受體酪氨酸激酶超家族、原癌基因Ret的基因突變引起的,AD57對腫瘤患者生存期的影響是通過抑制Ret、Raf、Src和S6K幾種激酶介導的,而毒性是通過抑制Tor引起的,通過合理的化學設計,設計出無Tor抑制活性但提高了Ret、Raf、Src、S6K抑制活性的候選藥物,提高了對II型多發性內分泌瘤的療效并降低了毒性。
在斑馬魚中,多維表型是指化學物質誘導的表型可以幫助科學家識別并追蹤該化合物的多個靶點。例如,基于斑馬魚與其他銅螯合劑和MEK抑制劑的共同表型和酵母化學-遺傳特征,確定了MEK抑制劑U0126既是銅螯合劑又是MEK抑制劑。
斑馬魚篩選也開始納入多靶點藥物的機制研究,這在基于行為的大規模表型篩選中特別有效。例如,科學家分析了結構多樣化的化合物和相關的斑馬魚行為特征,以識別具有復雜的多向藥理學機制的化合物,如氟哌啶醇,證明其通過多個靶點機制提供抗精神病作用。
對于某些藥物,斑馬魚在人體上的重現效果比在小鼠模型上更好。沙利度胺的情況就是很好的例子:這種藥物被用來治療孕婦的惡心癥狀,但導致數千名未出生的嬰兒出現出生缺陷。在小鼠實驗中,沙利度胺沒有引起任何缺陷,然而在斑馬魚實驗中,沙利度胺會導致與人類相同的肢體形態缺陷。在這兩個物種中,沙利度胺結合并激活E3泛素連接酶CUL4-RBX1-DDB1-CRBN(被稱為CRL4),通過斑馬魚模式動物對沙利度胺作用靶點的了解解釋了該藥對發育中的胎兒的嚴重影響,并使沙利度胺在新適應癥(骨髓瘤)上起死回生。
02 全動物綜合生理學
斑馬魚與人類有著幾乎相同的組織發育和內穩態,包括血液、肌肉、心臟、肝臟、胰腺、脾臟、腸道、腎臟、骨骼、脂肪以及神經元和神經嵴譜系等的發育。
藥物可以在斑馬魚中進行活體篩選,篩選藥效的同時提供了關于化合物的吸收、分布、代謝、排泄、毒性(ADME-tox)的性質。在目標組織中建立化合物活性譜,同時測試對其他組織的影響可以整合到迭代化學中以進行化合物開發和特異性研究。該方法提供了有關藥物或藥物組合藥理藥效和常見副作用的重要信息,包括因嚴重毒性而被限制應用的救命藥物。例如,多柔比星是一種拓撲異構酶II抑制劑,在殺死癌細胞方面非常有效,但伴隨心臟毒性和心力衰竭的巨大風險。這些相同的心臟毒性在斑馬魚中均能觀察到,通過藥物篩選發現了預防多柔比星誘導的心肌病的治療方案,發現了天然產物甲氧呋豆素,它可以在不改變多柔比星對癌細胞的細胞毒性的情況下預防心肌病。最近,這一綜合生理學的潛力得到了進一步開發,利用斑馬魚識別能夠防止順鉑劑量限制毒性的化合物。順鉑是一種常見的廣譜化療藥物,可導致腎損傷和耳聾。通過對腎臟和側線細胞進行雙管齊下的毒性反篩選試驗,發現多巴胺及其相關的調節因子具有耳保護作用,在不影響順鉑誘導神經母細胞瘤或口腔鱗狀細胞癌細胞死亡的情況下,具有腎保護作用。可見,斑馬魚模式動物在聯合用藥方案中起到了至關重要的作用。
03 藥物篩選
最早的斑馬魚藥物篩選僅僅是基于斑馬魚胚胎的發育表型,這一強有力的方法鑒定了世界上第一個骨形態發生蛋白(BMP)抑制劑,目前正在進行臨床試驗。斑馬魚系統跨越了整個藥物研發過程,從發現階段的高通量篩選到用于治療的臨床前藥理、藥效、安評模型。斑馬魚模型將成為藥物發現和藥物應用的臨床前平臺。人類基因數據與斑馬魚模型相結合,已經篩選出治療淋巴異常和動靜脈畸形患者的MAPK抑制劑,在Dravet綜合征中篩選到clemizole和lorcaserin,并均已經進入臨床II期試驗階段。斑馬魚藥物篩選和疾病模型已經使斑馬魚在藥物發現和開發管線中站穩腳跟,并使斑馬魚能夠為未來的治療做出更重要的貢獻。目前,斑馬魚模型可以覆蓋多種疾病類型,包括腫瘤、遺傳病、心腦血管疾病、血液疾病、中樞神經系統疾病、皮膚病和美容、再生醫學與器官再造、肝臟疾病、心臟病、骨骼疾病、行為障礙等。除此之外還在化妝品、保健食品、食品安全、環境監測中廣泛應用,這些應用不列入本次綜述的討論。
化合物可以在時間上有條件地影響斑馬魚發育路徑,而且表型是劑量依賴的。在不同發展階段添加化合物可觀察其對特定發育或疾病某一時間窗內的生理活性,觀察藥物如何隨著時間的推移,在整個斑馬魚的生命周期中改變細胞和組織生理學,并提供了化合物對器官間生理、脫靶或毒性作用的證據,以提高先導藥物篩選的命中率,并減少假陰性的數量。
全動物斑馬魚篩選試驗能夠在單細胞分辨率下對器官和組織的藥物活性進行深度表型分析。全面的篩選提供了捕獲發育生物學、細胞增殖、癌癥、感染和免疫、行為和毒性等動態的多種分析。例如,通過使用抗體(如磷酸化組蛋白- h3抗體)篩選可以在發育胚胎的單細胞水平上跟蹤蛋白質的表達或在采用整體熒光原位雜交(如crestin RNA表達)跟蹤基因表達;還可以利用斑馬魚從干細胞群體中再生組織的非凡能力進行干細胞藥物篩選,包括毛囊細胞的再生、色素細胞再生、骨骼和脊髓再生等等。
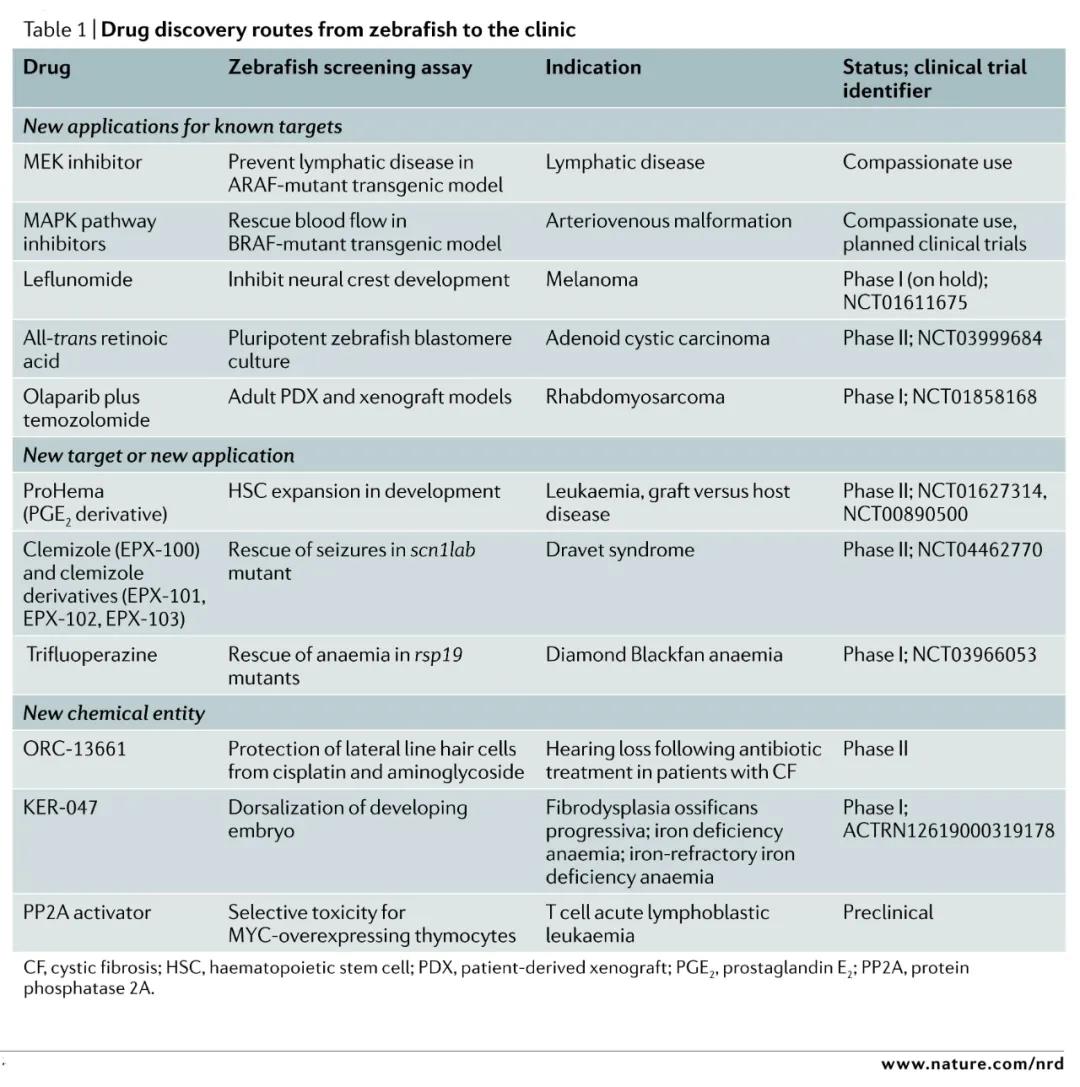
通過斑馬魚模式動物篩選的藥物已經有多種,但是這個方法卻不被國內所熟知。維渡縱橫列舉一部分通過斑馬魚模式動物篩選而發現的新藥案例:
熒光報告系統
在藥物篩選中,單細胞和組織也可以使用熒光報告系統在活體胚胎中篩選。例如,使用基因熒光定量表達作為讀取器對胰腺β細胞的調節因子進行篩選,發現了組蛋白去乙酰化酶(HDAC)抑制劑的全新分子,可以降低斑馬魚的葡萄糖水平甚至在高血糖的情況下,這些抑制劑被證明在小鼠和人類β細胞模型中具有同樣的功能。
共聚焦顯微鏡掃描
使用熒光報告分析進行高通量篩選,通過低分辨率顯微鏡或平板閱讀器即可完成,算然這限制了篩選試驗的細胞分辨率,但是自動化、高分辨率的胚胎活體藥物篩選圖像分析平臺已經解決了這個問題。這個平臺被用來篩選調節髓鞘化少突膠質細胞的小分子藥物,這些小分子藥物對軸突絕緣和支持中樞神經系統至關重要。在這個裝置中,斑馬魚胚胎被自動從液體中的多孔板中取出,并通過旋轉的薄壁玻璃毛細管拉出,被旋轉圓盤共聚焦顯微鏡掃描,這種方法不損害胚胎,使高通量、復雜、深度表型機制的藥物在體內篩選更容易。
可見表型篩選
篩選可見表型也可以用于復雜的心血管生物學和相關疾病。斑馬魚的心臟清晰可見,在發育48小時內血液循環活躍。斑馬魚幼體可表現出心血管疾病的關鍵指標,包括心肌病、心律失常和血管生成改變。這些特征使得對斑馬魚進行脊椎動物全器官功能的藥物篩選成為可能。心血管疾病是全球主要的死亡原因之一,目前心血管藥物的發現呈下降趨勢,斑馬魚藥物篩選有可能揭示新的、意想不到的心血管生物學和治療藥物線索。
斑馬魚的肝臟疾病與人類的疾病相似,甚至在胚胎階段也是如此,斑馬魚胚胎的透明特性實現了肝臟功能的動態讀數。斑馬魚肝臟疾病模型擴展到對乙酰氨基酚引起的毒性,這是藥物性肝毒性最常見的原因之一。通過對斑馬魚胚胎的小分子篩選,發現前列腺素E2(PGE2)和n -乙酰半胱氨酸(n - acetyl半胱氨酸)可以降低胚胎和成人對乙酰氨基酚肝毒性。
斑馬魚胚胎在發育3天后就開始游動,快速發育的數百個自由游動的斑馬魚胚胎為觀察復雜的斑馬魚行為提供了巨大機會。斑馬魚具有進化保守的動機和決策神經網絡,其行為分析是表型分析之一,而這些都可以用高速相機大規模捕捉到。斑馬魚和人類的神經藥理學高度類似,已經確定了100種余種斑馬魚胚胎行為是和人類行為一致的,可以作為中樞神經系統藥物篩選平臺,包括精神障礙、睡眠-覺醒周期、抑郁和焦慮、癲癇和神經退行性疾病、帕金森、阿爾茲海默癥等。
可見表型結合熒光報告系統
表型分析可以與斑馬魚的熒光報告分析相結合。最近,一項利用斑馬魚胚胎熒光報告基因和可見表型篩選晝夜節律調控分子的研究發現了非甾體抗炎藥 (NSAIDs) 和糖皮質激素類藥物,對炎癥藥物如何改變控制日常生理和代謝健康的晝夜節律產生影響。值得注意的是,抗炎和促炎化合物的作用在細胞培養中是不存在的,斑馬魚胚胎在這個復雜的生物過程中展現了前所未有的優勢。
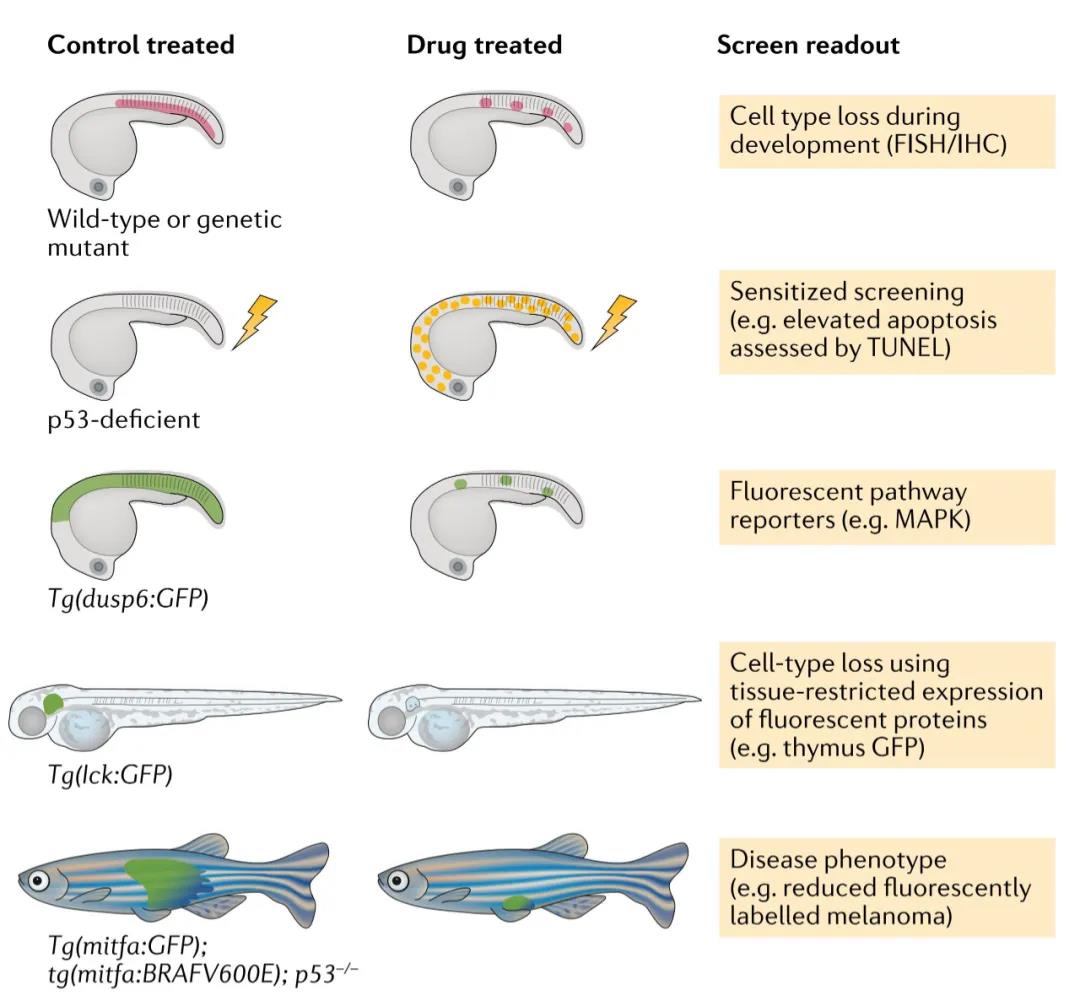
用于斑馬魚表型分析的藥物篩選方法舉例
熒光原位雜交(FISH)、免疫組織化學(IHC)或組織特異性熒光轉基因表達可用于鑒定在胚胎、幼蟲和成年斑馬魚中消融特定細胞類型(包括癌細胞)的藥物。致敏篩選使用遺傳突變動物或者是出現給藥后表型的逆轉。在所提供的例子中,當通過全安裝末端脫氧核苷酸轉移酶dUTP缺口末端標記(TUNEL)評估時,可以鑒定出使p53缺陷胚胎對輻射誘導的細胞殺傷敏感的小分子。閃電表示DNA受損,如輻射。可以使用轉基因方法,其中熒光蛋白在由特定分子途徑激活的基因啟動子的控制下表達。例子中,DUSP6是RAS途徑活性的一個眾所周知的靶標,可用于鑒定該途徑中的抑制藥物。
二、從斑馬魚到人類疾病治療
在過去的15年里,斑馬魚的化學生物學進展迅速。藥物篩選的許多最初的障礙已經得到解決。藥物發現科學家與臨床科學家、藥物化學家、制藥業將緊密互動,將化合物從實驗室轉移到臨床應用,將開啟斑馬魚模式動物藥物發現時代的新紀元。
01 藥物發現高通量篩選
斑馬魚的高通量藥物篩選多選用斑馬魚胚胎模型。科學家將斑馬魚胚胎排列到多孔板中,每個孔包含不同的化合物或者化合物組合或中藥提取物。斑馬魚胚胎可以在生理藥物濃度下主動吸收上述分子,通過熒光報告基因或其他表型分析來篩選起作用的化合物,即先導化合物。確定了先導化合物后,可以通過斑馬魚模型評估藥效藥理、毒性反應、吸收、分布、代謝、排泄,并通過斑馬魚胚胎構效關系分析 (SAR) 快速優化先導化合物的衍生物,獲得最優的候選藥物。候選藥物通過轉基因小鼠模型或異種移植模型進行體內研究,再配合比格犬、猴子等模式動物研究結果,候選藥物進入人體臨床試驗,通過臨床I期、臨床II期、臨床III期后成為真正的藥品上市銷售。
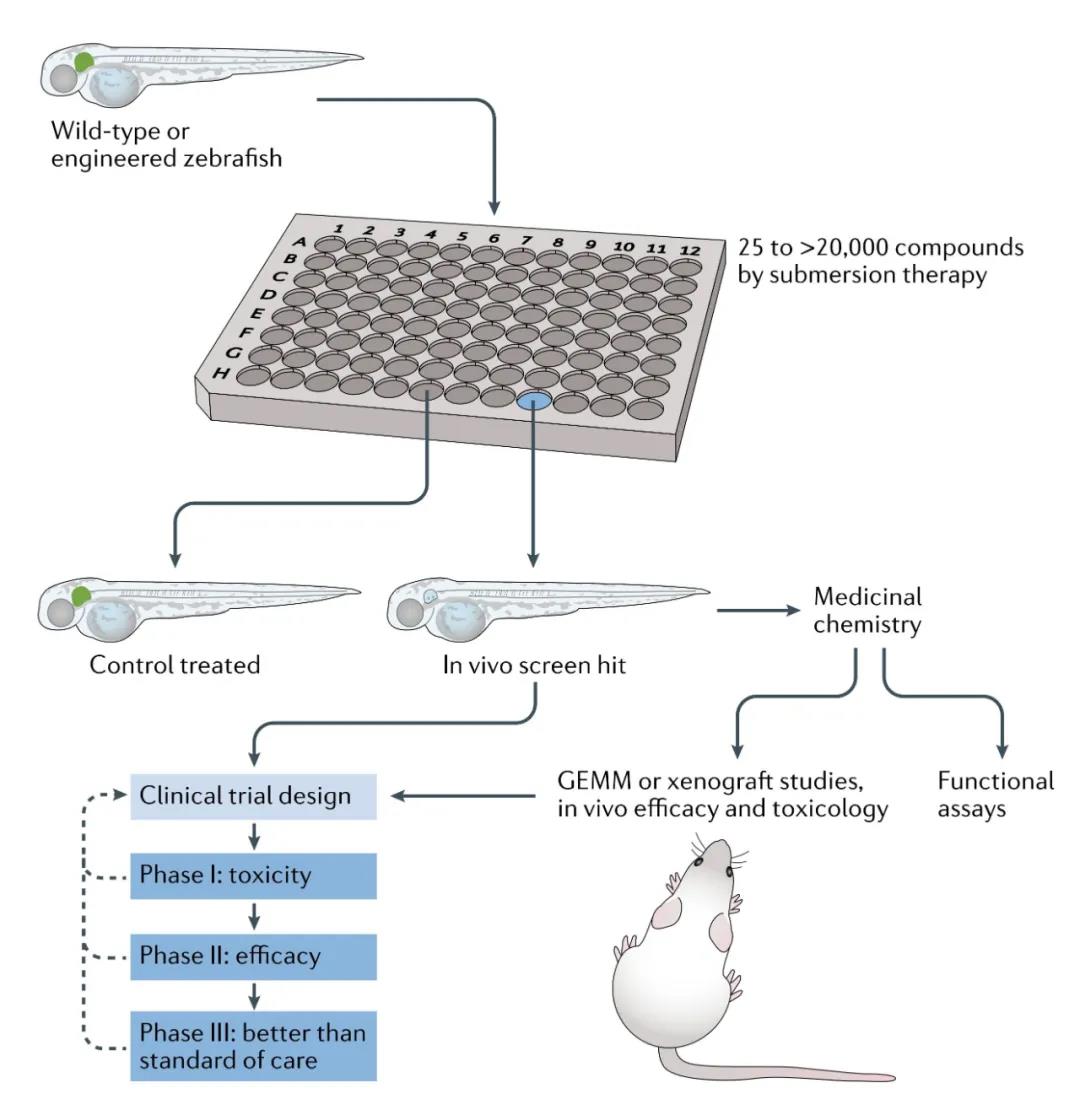
斑馬魚的藥物發現到臨床優化過程
02 靶標確證和作用機制研究
表型篩選的優點之一是藥物的分子靶標不需要已知,也不需要假設其在疾病中的作用。對于靶標未知的化合物,確定其作用機制的一種技術是將藥物誘導的表型與已知的基因誘導表型進行比較,確證靶標和該藥物的作用機制。斑馬魚模型被用于追蹤或發現藥物靶標據有獨特的天然優勢。
例如,2021年12月7日,同濟大學宋建人團隊在Nature Communications雜志上以題目“An injury-induced serotonergic neuron subpopulation contributes to axon regrowth and function restoration after spinal cord injury in zebrafish”發表了研究論文,系統的解析了脊髓中央模式產生器在脊髓損傷后的修復規律,揭示了脊髓內源性的五羥色胺參與的促進神經軸突再生修復的機制,并找到了參與該修復機制的內源性新靶點,為脊髓損傷的基礎研究和治療提供了新的思路。
三、轉基因斑馬魚帶來的奇跡
轉基因斑馬魚的臨床前模型最近已成為藥物治療的熱點,并創造出了奇跡。
丹尼爾(Daniel)一出生就帶著一種罕見遺傳病——中樞傳導淋巴異常(central conducting lymphatic anomaly, CCLA)。他的腿和肚子腫得像吸了水的海綿,肺部全是液體,難以呼吸,全靠一個氧氣瓶活著。2019年,就在費城兒童醫院醫生Hakon Hakonarson認為丹尼爾只有“等死”的時候,他們發現了疾病的根源。他們對丹尼爾的基因進行了測序,包括產生蛋白質的基因組——外顯子組,以及與淋巴異常相關的十幾個基因,結果發現只有X染色體上的一個名為ARAF的基因顯示不正常。然而,ARAF突變之前從未被發現與淋巴疾病有關。為了證明這一點,Hakonarson想到了已經成為無數遺傳學、發育和疾病研究的首選實驗動物——斑馬魚。
Hakonarson將這種基因突變通過基因工程改造進斑馬魚體內,等斑馬魚形成和丹尼爾相同的病癥時,在斑馬魚身上測試多種藥物,如果能發現其中一種藥物可以阻止淋巴管的生長,并且該藥物能獲得聯邦衛生部門的許可,那么就可以在兒童患者身上進行嘗試。
按照計劃,斑馬魚5天內就長成了淋巴系統,并給了一組ARAF突變的斑馬魚10種不同藥物。“只要將藥物放入水中,這些斑馬魚就能吸收藥物。”Seiler說,“不需要像用小鼠模型要一只只注射那么麻煩。”終于他們發現了——trametinib,一種商品名為Mekinist的黑色素瘤藥物,研究人員將該藥物放入水中,斑馬魚在吸收藥物后淋巴管停止擴散,并且沒有對其他組織和器官造成傷害。
經FDA批準,費城兒童醫院團隊給丹尼爾開了 trametinib。奇跡出現了。用藥2個月,丹尼爾的呼吸得到改善。服藥三個月時,他肺部的液體已經消退,不再需要另外補充氧氣,雙腿的腫脹也消失了,核磁共振顯示他的淋巴管已重塑成接近正常的狀態。據STAT報道,這是一種藥物首次重塑整個器官系統。
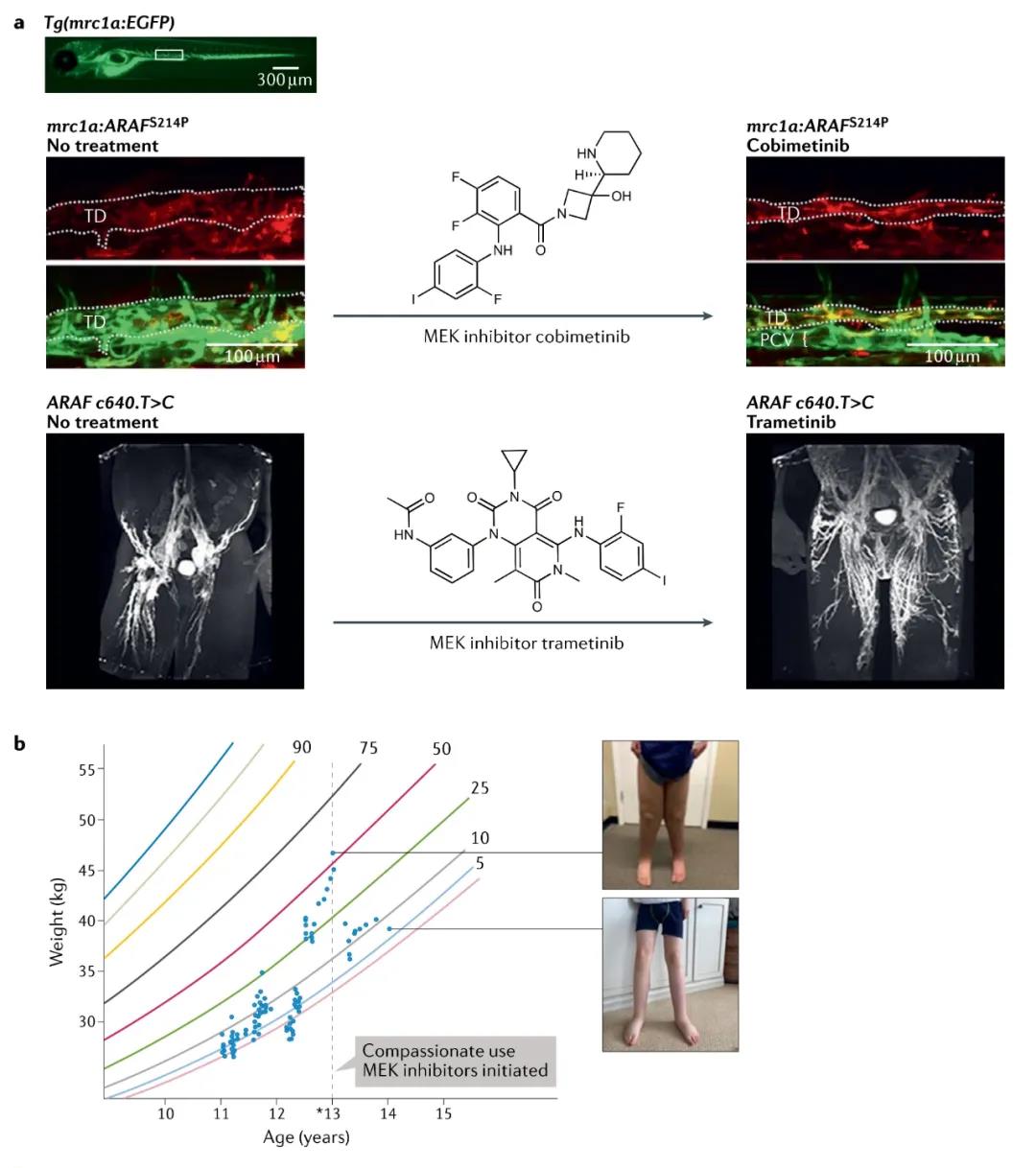
“一項研究可能失敗上千次,才成功一次。”Seiler說,“但是在斑馬魚身上測試所顯示的結果能夠直接用回臨床診療中,這簡直太給力了。”現在14歲的丹尼爾可以打籃球,騎自行車,還幫助教練練足球。
這項研究發表在2019年的《Nature Medicine》雜志上。

除此之外,轉基因斑馬魚模型用于T細胞急性淋巴細胞白血病、肝細胞癌、癌癥RAS通路等的創新藥物已經紛紛進入臨床試驗研究。
四、斑馬魚移植模型新突破
01 同種/異種腫瘤移植模型
使用幼體和成年魚的同種/異種移植試驗為評估藥物在活體動物體內對人類癌癥的治療提供了新機會。
斑馬魚移植模型分為同種異體移植模型、幼魚的異種移植模型、免疫缺陷魚的異種移植模型。斑馬魚異種移植模型可以進行癌癥藥物療效的臨床前測試:可直接移植人類腫瘤移植物至斑馬魚,形成異種移植模型進行藥物測試。通過對魚體內熒光腫瘤的成像,以及對單細胞終點(如細胞周期或藥物靶標通路)的高分辨率成像,可以監測藥物效應,可以進一步測試其毒性。
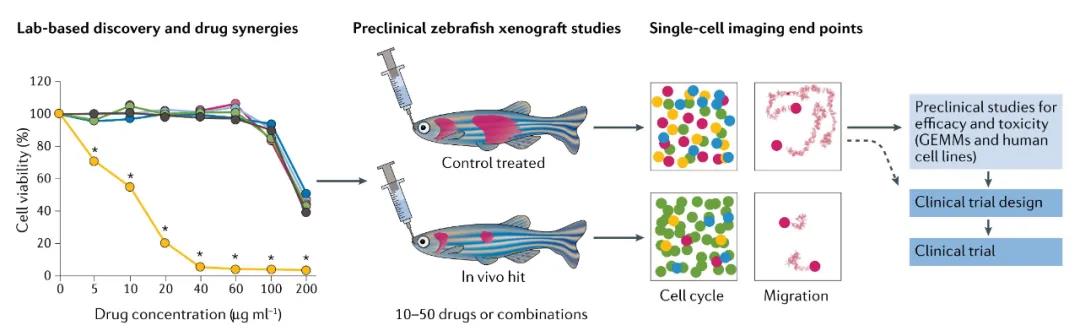
隨著基因組工程技術的發展,已經培育出缺乏T細胞、B細胞和自然殺傷細胞(NK)的免疫缺陷成年斑馬魚,為“免疫缺陷魚異種移植模型”提供了基礎工具。這些模型的優點包括能夠在37°C的環境下飼養魚類、以臨床可實現的方式使用口服灌胃而不是浸泡療法給藥、以及植入足夠的細胞使其形成具有與人類患者類似的組織學和長期生長動力學的腫瘤。
2019年,David M.Langenau和Yan Chuan在世界上首次培育出缺乏T細胞、B細胞、NK細胞但仍能存活到成年的復合突變斑馬魚,可以穩定地移植多種人類癌癥,包括黑色素瘤、三陰性乳腺癌、橫紋肌肉瘤等。給橫紋肌肉瘤斑馬魚移植模型灌胃給藥,發現PARP抑制劑奧拉帕尼聯合替莫唑胺是一種新的人類橫紋肌肉瘤治療方法。重要的是,這項工作使用了口服灌胃和給藥程序,模擬了臨床可以達到的給藥頻率和血液水平。基于斑馬魚藥物發現以及后期在PDX小鼠模型中的驗證,該藥物組合現在已經進入臨床試驗(NCT01858168)。
02 干細胞移植
移植是測定造血干細胞(HSCs)體內功能最常用的方法。盡管已經在斑馬魚中開發了各種HSC移植策略,但由于與免疫匹配和預處理毒性相關的挑戰,它們并未得到充分利用。為了規避這些限制,Teresa V.Bowman使用HSC缺陷宿主開發了一個簡單而強大的移植模型。該測定的簡化方法和穩健性將有助于擴大其未來在斑馬魚中進行高通量移植實驗的可行性,并將促進造血干細胞生物學的進一步新發現。
五、盤點斑馬魚模式動物CRO

研究顯示,國外大藥廠包括諾華、禮來、輝瑞、羅氏、賽諾菲、葛蘭素史克等均已采用斑馬魚模式動物進行藥物發現研究。而當前,專注斑馬魚模式動物的CRO公司還不多,主要有Phylonix Pharmaceuticals、Evotec、Biobide、Zeclinics、環特生物、英創新藥、斑馬藥業、羿晟生物、再本生物,有少量涉及該業務的CRO國內還有南模生物。
公益性質的包括Zebrafish Disease Models Society。
斑馬魚模式動物CRO目前服務內容涵蓋小分子藥、中藥、抗體藥、核酸藥、基因治療、化妝品、保健品、食品安全等的全方位服務。從環特生物官網來看,目前服務客戶呈現多元化。

六、展望
藥物發現仍然是一個昂貴和費力的過程,實驗室研發和臨床試驗之間巨大的科學差距加大了藥物開發的難度。鑒于斑馬魚和人類對藥物的共同反應,斑馬魚與小鼠、猴子等哺乳動物的臨床前預測模型一樣強大。斑馬魚和人類共同的藥理學使斑馬魚成為藥物再利用的重要伙伴,也是發現新分子實體的新興工具,從而打開了新藥開發的嶄新的鑰匙。
引用資料
[1] E. E. Patton, L. I. Zon, D. M. Langenau. Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov, 2021, 611-628.
[2] Li, D., March, M.E., Gutierrez-Uzquiza, A. et al. ARAF recurrent mutation causes central conducting lymphatic anomaly treatable with a MEK inhibitor. Nat Med. 2019, 25, 1116–1122.
[3] Yan, C. et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 2019, 177, 1903–1914.
[4] Ellen Fraint, María Feliz Norberto, Teresa V. Bowman, A novel conditioning-free hematopoietic stem cell transplantation model in zebrafish. Blood Advances, 2020, 4, 6189-6198.
[5] ZDMC:https://www.zdmsociety.org





 17312606166
17312606166