摘要:斑馬魚已經在發育生物學和藥物遺傳學中成為流行的模式生物。結合強大的遺傳和轉基因工具,透明的胚胎和快速的幼體發育,斑馬魚的研究允許對許多動態過程進行詳細的細胞分析。近幾十年來,利用斑馬魚模型對性腺發育過程中的細胞和分子機制進行了深入的研究。我們簡要概述了這些研究,并重點介紹了斑馬魚性別確定和性腺發育中涉及的必需基因。
關鍵詞:性腺發育 斑馬魚 基因
簡介:在動物中,存在兩種不同的性別,這對于有性繁殖和物種的生存至關重要。 然而,性別決定的機制是變化多端且人們對其知之甚少。與大多數其他高度保守的發育過程相反,沒有一個基因網絡可以控制所有物種的性別決定。斑馬魚作為研究生物越來越受歡迎,特別是在胚胎發育研究和疾病模型方面。Cas9相關轉基因技術和單細胞RNA序列分析的最新進展也為了解特定魚類的性別決定和性腺發育的細胞事件提供了機會。這些數據使我們能夠將斑馬魚中的性腺發育與其他動物中的性腺發育進行比較。
斑馬魚的性別確定和性腺發育:脊椎動物的雄性和雌性生殖道來自同一胚胎組織。 性別決定是指性腺分化為睪丸或卵巢所涉及的關鍵事件。在斑馬魚中,性腺的發育首先經歷了卵巢樣階段。 受精后第10天(dpf),所有性腺中均可發現早期卵母細胞。雖然直到15dpf才出現有絲分裂活動的跡象,但早期的二倍體卵母細胞可以觀察到一個清晰的幼年卵巢結構,這表明脊椎動物卵子早期發生。Selman等人根據斑馬魚卵巢的形態和核型,將斑馬魚的卵子發生過程分為五個階段。基于此,性別分化的特征是出現核周卵母細胞,最早出現在17 dpf。在21 dpf時在性腺中出現這兩種分化模式,而在22 dpf時一些性腺開始減數分裂。依賴于多種信號網絡,大約一半的幼年卵巢維持著卵子發生的途徑,另一半的個體經歷凋亡,啟動“幼年卵巢到睪丸”的性腺轉化過程,最終轉化為睪丸。到25 dpf時,仍然是雙性。31 dpf可觀察到性腺的三種形態,包括有核周卵母細胞的幼年卵巢、成熟卵母細胞的假定卵巢、卵母細胞凋亡并發育精原囊腫的假定睪丸。在40 dpf時,雌性性腺在卵子發生的各個階段都含有生殖細胞,而在其他性腺中,退化卵母細胞被觀察到并被認為是生精活動的第一個跡象。
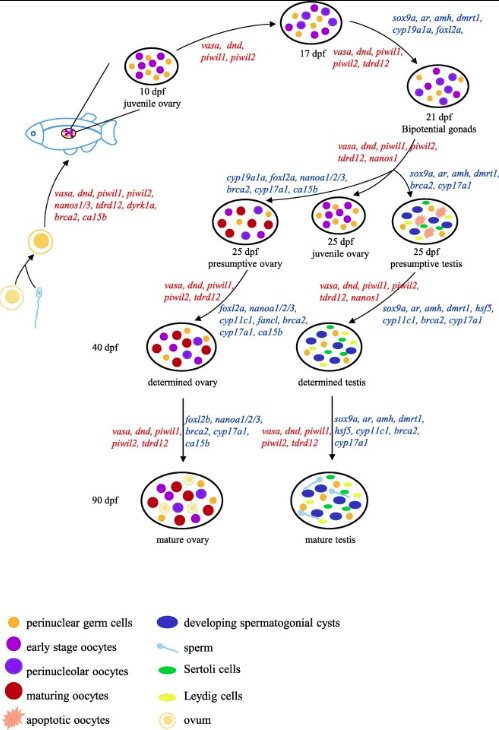
圖1、斑馬魚性腺發育過程中的基因網絡。不同的基因在不同的階段扮演著重要的角色,完成性別決定和性腺發育的復雜生命過程。不同顏色或形狀的圖形表示不同類型的細胞。
斑馬魚生殖發育的基因網絡:性別確定機制主要可以分為兩種,遺傳性別確定(GSD)和環境性別確定(ESD)。 GSD可以具有單基因或多基因基礎。XX / XY系統和ZZ / ZW系統是GSD的兩個典型系統。 魚類中存在多種性別決定機制,包括GSD,ESD或GSD-ESD相互作用。斑馬魚沒有所謂的“異形性染色體”,它決定人類和其他幾種物種的性別。斑馬魚表現出多基因的性別決定,也受到環境的影響。實驗室品系缺乏明確的與性相關的性染色體位點,但印度的野生株在Chr4上具有位點,可作為具有環境影響的ZZ / ZW性染色體系統。研究人員已經知道環境因素,例如水溫,可以改變斑馬魚種群的性別比。但是,涉及性別確定的基因網絡仍然不清楚,有時還存在爭議。 在這里,我們總結了對斑馬魚的性別決定和性腺發育至關重要的基因。
生殖細胞特異性基因:
多細胞生物有性生殖需要正確的生殖細胞規格和維持。雖然生殖細胞的規格因物種而異,但分子因子基本上是保守的。vasa和dnd1(以前的名稱:dnd)始終用作生殖細胞特異性標記。 在卵裂期檢測到母源性vasa和dnd1。 已經表明,這兩個基因的表達對于生殖細胞的遷移,存活和維持至關重要。Piwi基因已被鑒定為負責干細胞和生殖細胞分化的調節蛋白。在斑馬魚中,Piwi同源物piwil1和piwil2在雄性和雌性性腺中都表達。 piwil1在胚胎生殖和成年性腺的原代生殖細胞中表達,與vasa共定位。據Houwing等人報道,在幼蟲發育過程中piwil1的缺失會觸發生殖細胞凋亡。與piwil1一樣,piwil2的丟失也有顯著的影響,導致生殖細胞無法分化成成熟的卵母細胞或精子。編碼母體mRNA的nanos1在早期胚胎發育階段在PGC中表達,對PGC的存活和遷移至關重要。已證明Tudor結構域相關蛋白(Tdrds)充當Piwi相互作用蛋白,參與精子發生。缺乏tdrd12的魚類顯示出的生殖細胞數量減少,最終35 dpf時損失生殖細胞。 此外,在tdrd12突變體衍生的生殖細胞中也觀察到減數分裂缺陷。這些基因的正確表達對PGCs的健康形成和性腺的正常發育至關重要。純合子敲除斑馬魚或這些生殖細胞特異基因的突變體(vasa、dnd1、piwil1、piwil2、nano1和tdrd12)通常都是雄性的,睪丸呈線狀;雖然這些魚可以與雌性交配并刺激產卵,但卵沒有受精。另外,ca15b在早期胚胎的PGCs中表達,其表達與vasa相似,表明ca15b是PGCs發育所必需的。另外,dyrk1a的表達始于2細胞期,并存在于斑馬魚囊胚期的所有細胞中,這與PGCs的正常形成有關。dyrk1a的過度表達導致與PGCs發育相關的兩個重要因子ca15b和piwil1的表達降低,導致PGCs數量減少和遷移紊亂。斑馬魚dyrk1a與人類DYRK1A高度保守,這項工作可能為唐氏綜合癥患者的生殖細胞缺陷提供可能的機制。
睪丸相關基因:
睪丸的正確分化和發育是生殖的基本前提。sox9a,dmrt1,amh,ar和hsf5基因在斑馬魚的“卵巢到睪丸”階段和睪丸成熟后期階段中起著重要作用,所有這些對于正確分化和發展睪丸至關重要。SRY-box轉錄因子9a(sox9a)在斑馬魚體內的表達在18dpf時達到第一個高峰,下一個高峰與ar表達高峰在22dpf時一致,此時雙潛能性腺開始向卵巢或睪丸分化。在睪丸中,sox9a被證明是amh的上游正調節劑和cyp19a1a的上游負調節劑。Webster等人證明了doublesex和與mab-3相關的轉錄因子1(dmrt1)對于睪丸的發育是必不可少的,但對于卵巢的發育則是不必要的; dmrt1還通過amh和foxl2基因的轉錄調控促進雄性發育。抗Müllerian激素(amh)是影響雄性性腺發育的重要因素。它對Müllerian導管的退行以及控制雄性生殖細胞增殖和分化的平衡具有重要意義。雄激素受體(ar)與雄激素相互作用,在雄性發育中發揮功能。 ar的轉錄本在16 dpf和22 dpf時達到峰值,隨后在推測的雄性發育階段均保持在較高的穩定水平,這表明它對于雄性分化和維持至關重要。Saju等。 發現熱休克轉錄因子家族成員5(hsf5)的表達從35dpf開始增加,在雄性精子發生和生育的早期階段起著重要作用。總之,純合子敲除斑馬魚或這些睪丸相關基因(dmrt1、amh和ar)的突變體通常表現出雌性偏向的性別比例。特別地,sox9a的異常表達可以阻止斑馬魚幼魚的卵巢-睪丸轉化。 缺乏dmrt1表達的雄性腺會導致amh基因表達受損,從而使foxl2基因的表達不再受到限制。相反,在這些dmrt1突變體中,雌性卵巢發育正常。在純合型amh突變雄性中,由于生殖系的不可控增殖和分化缺陷,可觀察到睪丸肥大,生殖細胞增多,精子較少。無ar雄性斑馬魚具有雌性次生性特征,不育,睪丸較小,精子發生受阻。hsf5-/-突變型雄性不育,精子數量減少,精子形態異常,精子活力降低,但是雌性可育。
卵巢相關基因:
產生卵子并分泌雌激素的卵巢是雌性腺的核心。 諸如cyp19a1a,foxl2,fancl,ca15b,nanos1,nanos2和nanos3等基因共同調節卵巢的正確形成和功能。sox9a的低表達或無表達阻止雙潛能性腺發育成雄性性腺;隨后,性腺開始向雌性分化,cyp19a1a表達增加。cyp19a1a基因編碼的芳香化酶限制了從睪丸激素向雌激素的轉化速率,并且在性別分化過程中起著雙重作用:cyp19a1a的低表達對于睪丸分化是必需的,而cyp19a1a的高表達對于卵巢分化和維持雌性至關重要。foxl2對于哺乳動物卵巢發育和維持至關重要。 斑馬魚中有兩個foxl2同源基因,分別名為foxl2a和foxl2b。在卵巢分化和發育過程中,foxl2a的表達高于foxl2b,成熟卵巢中foxl2b的表達更為豐富。foxl2a和foxl2b的功能是相輔相成的,它們共同調節卵巢的發育和維持,而foxl2b在卵巢維持和預防轉化雄性中起著更具體的作用。fancl,Fanconi / BRCA DNA修復途徑的成員,在發育中的卵母細胞和精母細胞中表達。 特別是,fancl通過減數分裂使卵母細胞前進,同時維持cyp19a1a表達并下調amh表達,對卵巢的分化和發育至關重要。此外,如前所述,ca15b在早期胚胎的PGC中表達。 Wang等人還發現ca15b在成年雌性的卵母細胞中表達,這表明ca15b可能在卵子發生中具有重要作用。此外,在雌性性腺發育過程中,nanos1的表達對于維持卵母細胞的生成是必需的。nanos2和nano3對維持卵巢生殖系干細胞(GSCs)很重要。
這些卵巢相關基因的異常表達可導致各自的異常表型。cyp19a1a缺失突變斑馬魚雌激素的生物合成是有缺陷的,雖然雄性cyp19a1a突變體是可育的,但雌激素的作用會導致卵巢樣性腺在性別分化過程中消失,并導致所有雄性的性別分化延遲。此外,cyp19a1a表達失調導致其他基因如sox9a、amh、dmrt1和foxl2在性腺分化期的異常表達。foxl2a突變純合子具有正常的1:1性別比,而foxl2b破壞會導致成年雌性部分性逆轉。 foxl2a-/-和foxl2b-/-突變體最初都執行正常的卵巢分化和卵母細胞發育。然而,成熟后,睪丸相關基因(sox9a、amh和dmrt1)表達增加,而與之相反,卵巢相關基因cyp19a1a在foxl2a–/–或foxl2b–/?雌性突變體中表達減少。雌性成年斑馬魚的卵巢加速老化和卵母細胞減數分裂異常,與人類患者卵巢早衰(POF)相關的情況相似。在斑馬魚中,一些foxl2b–/?純合子雌性突變體從180 dpf開始發生性反轉。此外,foxl2b基因缺陷的雌性同時出現了性反轉。fancl純合突變體由于雌雄性反轉而發育為所有可育雄性。異常凋亡導致卵母細胞缺失,雌性特異性基因(如cyp19a1a)表達無法維持,雄性特異性基因(如amh)表達上調。另外,nanos1突變體雌性在受精后6個月完全不育,而nano3突變體成年雌性最初是可育的,但在5個月后轉變為不育。
其他重要基因:
除上述基因外,還有一些基因在雄性和雌性斑馬魚的發育過程中起著重要作用,調節它們性腺的發育。這里我們介紹brca2、cyp17a1和cyp11c1的功能。斑馬魚fancd1(brca2)和fancl與人類FANCD1(BRCA2)和FANCL同源,在結構和功能上均保守。它們是Fanconi Anemia(FA)基因中的兩個,有助于DNA修復和維持基因組穩定性。上面已經描述了fancl的功能。brca2在斑馬魚發育期卵母細胞和成熟卵母細胞中均有表達,而在睪丸中,brca2在精原細胞和發育精母細胞中均有表達,但在成熟精子中不表達。brca2是建立或維持卵母細胞核結構所必需的,對卵巢發育至關重要。所有純合的brca2成年突變體均為男性,這是由于卵母細胞在幼年期未能通過減數分裂而進展,導致雌性至雄性逆轉。
cyp17a1參與產生雌激素和雄激素的類固醇生成途徑,對斑馬魚的性發育具有重要意義。雄性激素是睪丸發育所必需的,維持雄性典型的第二性征和正常的交配行為。同時,雌激素對卵巢分化是必不可少的。cyp17a1缺乏的斑馬魚都是雄性,因為雌激素的生物合成受阻。同時,雄性也表現出雌性的特征,包括淺黃色的肛鰭著色和深黑色的身體色素沉著,以及失去平行游泳和抓握的能力,導致雌性產卵失敗,這是由于雄激素合成受損造成的。
斑馬魚cyp11c1編碼11β-羥化酶,對11-酮睪酮(11-KT)和皮質醇的生物合成具有重要作用。Zhang等人發現cyp11c1在30和35dpf時都在睪丸和卵巢中表達,然后在45 dpf后在睪丸中特異表達。與野生型相比,cyp11c1–/?魚類的性別比沒有顯著差異。
綜上所述,這些優勢意味著未來斑馬魚旨在了解復雜性腺發育的工作將有可能支持和改善我們的生理病理學知識,對人類具有診斷和治療潛力。
原文出自:https://www.sciencedirect.com/science/article/pii/S2001037020303780





 17312606166
17312606166