脊椎動物造血發育過程分為初級造血和次級造血兩個階段,初級造血主要產生初級髓系和紅系細胞,次級造血主要產生造血干祖細胞。其中,初級血細胞作為重要的微環境細胞組分,在多個層面參與造血干祖細胞發育的調控[1]。比如,初級髓系細胞能通過分泌炎性信號[2]、降解胞外基質[3]等促進造血干祖細胞產生。但是,初級紅細胞在生理或病理狀態下對造血干祖細胞產生的影響尚不明確。哺乳動物中,初級紅細胞缺陷突變體由于胚胎缺氧而致死,胚胎不能存活至次級造血階段[4]。而斑馬魚胚胎在體外發育,發育早期可以通過滲透作用吸收氧氣,因此斑馬魚初級紅細胞缺陷的胚胎可以存活至次級造血階段[5, 6]。此外,紅細胞發生和鐵代謝密切相關。近年研究表明,骨髓微環境中鐵的濃度能影響造血干細胞命運決定[7],特定病理狀態下的造血干細胞也對鐵死亡敏感[8]。然而,胚胎發育過程中,鐵穩態是否影響造血干祖細胞的產生也仍不清楚。
近期,中國科學院動物研究所劉峰研究組在Development雜志上發表了題為“Heme-deficient primitive red blood cells induce HSPC ferroptosis by altering iron homeostasis during zebrafish embryogenesis”的研究論文。在這篇文章中,研究人員揭示了血紅素缺陷初級紅細胞導致造血干祖細胞鐵死亡的調控機制。

首先,研究人員使用反義寡核苷酸(Morpholino)基因敲降技術構建了斑馬魚初級紅細胞發育缺陷模型,篩選后發現只有在敲低紅細胞血紅素合成限速酶編碼基因alas2和alad的斑馬魚胚胎中出現造血干祖細胞缺陷表型。隨后在功能缺失突變體中證實了造血干祖細胞缺陷的表型。進一步研究發現,alas2和alad缺陷的胚胎中,紅細胞數目不受影響,但血紅蛋白缺失,機體鐵代謝異常,紅細胞出現鐵聚集的表型。
隨后,研究人員通過檢測血清鐵含量,證實了血紅素缺陷的異常紅細胞會導致血液鐵過載。分選紅細胞進行轉錄組測序分析,以及抑制劑處理實驗進一步證實了異常初級紅細胞通過鐵轉運蛋白(Slc40a1)介導鐵的外排,導致血液鐵過載。而血液鐵過載和造血干祖細胞缺陷密切相關。通過使用gata1 morpholino注射的方式,阻礙突變體中初級紅細胞的產生,不僅能恢復血液鐵水平,還能回救造血干祖細胞缺陷表型。進一步證實了異常初級紅細胞引起的血液鐵過載是導致造血干祖細胞缺陷的重要因素。
上述結果提示,造血干祖細胞的數目減少可能與鐵死亡相關。研究人員通過掃描電鏡成像,發現alas2和alad突變體中,造血干祖細胞呈現出明顯的鐵死亡特征改變,包括線粒體形態變化、細胞質膜的破壞等(圖1)。進一步檢測發現alas2和alad突變體中造血干祖細胞促鐵死亡相關的大分子氧化酶編碼基因表達量升高,抗鐵死亡相關蛋白(包括Fth1、Gpx4和Slc7a11)含量減少。除此之外,研究人員使用鐵螯合劑(DFO)以及鐵死亡抑制劑(Ferrostatin-1)處理都能有效回救造血干祖細胞缺陷的表型。以上結果表明,alas2和alad突變體中造血干祖細胞發生了鐵死亡。
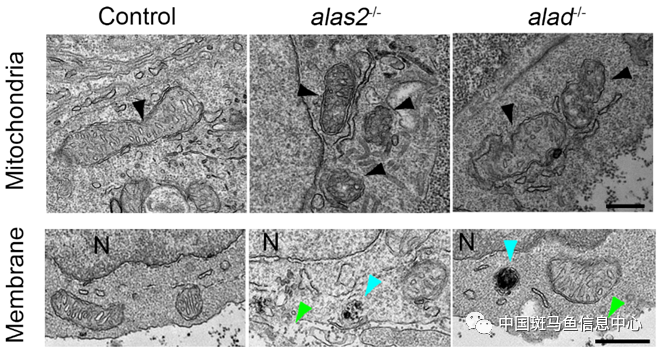
圖1 alas2和alad突變體中造血干祖細胞出現明顯鐵死亡特征表型
此外,進一步功能實驗證實了造血干祖細胞通過轉鐵蛋白受體(Tfr1b)響應鐵過載環境,導致過量鐵的攝入。氧化應激相關檢測表明,過量鐵引起造血干祖細胞活性氧水平升高,細胞氧化應激壓力升高。結合脂質氧化組學檢測,證實了花生四烯酸類脂質過氧化是導致造血干祖細胞鐵死亡的直接原因。最后,研究人員通過造血干祖細胞移植實驗,初步明確了受鐵死亡影響的主要為紅系傾向性的造血干祖細胞。
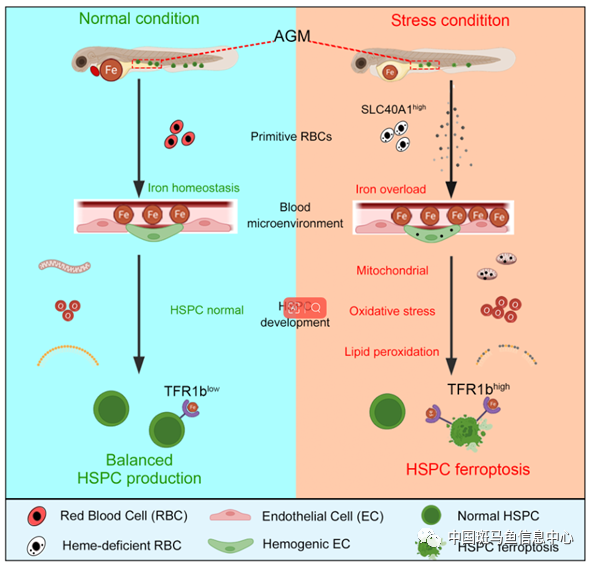
圖2 工作模式圖
綜上所述,這項研究發現,在alas2和alad突變體中,血紅素缺陷的初級紅細胞導致造血干祖細胞鐵死亡。機制上,異常紅細胞通過Slc40a1導致血液鐵過載,而造血干祖細胞Tfr1b介導了過量鐵的攝入,進而通過鐵-活性氧-脂質氧化軸介導了造血干祖細胞的鐵死亡(圖2)。該研究揭示了紅細胞鐵穩態在造血干祖細胞發育過程中的重要作用,為鐵代謝異常導致的惡性血液疾病提供了潛在的臨床指導。
參考文獻:
1. Vink, C.S., S.A. Mariani, and E. Dzierzak, Embryonic Origins of the Hematopoietic System: Hierarchies and Heterogeneity.Hemasphere, 2022. 6(6): p. e737.
2. Espin-Palazon, R., et al., Proinflammatory signaling regulates hematopoietic stem cell emergence. Cell, 2014. 159(5): p. 1070-1085.
3. Travnickova, J., et al., Primitive macrophages control HSPC mobilization and definitive haematopoiesis. Nat Commun, 2015. 6: p. 6227.
4. Baron, M.H., J. Isern, and S.T. Fraser, The embryonic origins of erythropoiesis in mammals. Blood, 2012. 119(21): p. 4828-37.
5. Lyons, S.E., et al., A nonsense mutation in zebrafish gata1 causes the bloodless phenotype in vlad tepes. Proc Natl Acad Sci U S A, 2002. 99(8): p. 5454-9.
6. Ransom, D.G., et al., The zebrafish moonshine gene encodes transcriptional intermediary factor 1gamma, an essential regulator of hematopoiesis. PLoS Biol, 2004. 2(8): p. E237.
7. Zhang, D., et al., The microbiota regulates hematopoietic stem cell fate decisions by controlling iron availability in bone marrow. Cell Stem Cell, 2022. 29(2): p. 232-247 e7.
8. Zhao, J., et al., Human hematopoietic stem cell vulnerability to ferroptosis. Cell, 2023. 186(4): p. 732-747 e16.




 17312606166
17312606166