人的心臟在出生后幾乎完全喪失再生能力。因此,心肌受損---例如心臟病發(fā)作---通常會(huì)導(dǎo)致成年人永久性喪失功能。在一項(xiàng)新的研究中,來自德國(guó)馬克斯-普朗克心肺研究所的研究人員如今首次在小鼠身上證實(shí)心肌細(xì)胞能量代謝的改變能夠使心臟再生。因此,小鼠的心臟功能可以在心臟病發(fā)作后得到很大程度的恢復(fù)。這一發(fā)現(xiàn)具有開創(chuàng)性意義,可能能夠?qū)е氯碌闹委煼椒āO嚓P(guān)研究結(jié)果發(fā)表在2023年10月19日的Nature期刊上,論文標(biāo)題為“Inhibition of fatty acid oxidation enables heart regeneration in adult mice”。

成體心臟之所以喪失再生能力,主要是因?yàn)樾募〖?xì)胞在出生后喪失了分裂能力。與此同時(shí),心肌細(xì)胞的能量代謝也發(fā)生了根本變化:它們不再?gòu)奶欠郑刺墙徒猓┲蝎@取能量,而是主要從脂肪中獲取能量。這種能量產(chǎn)生方式被稱為脂肪酸氧化(fatty acid oxidation)。
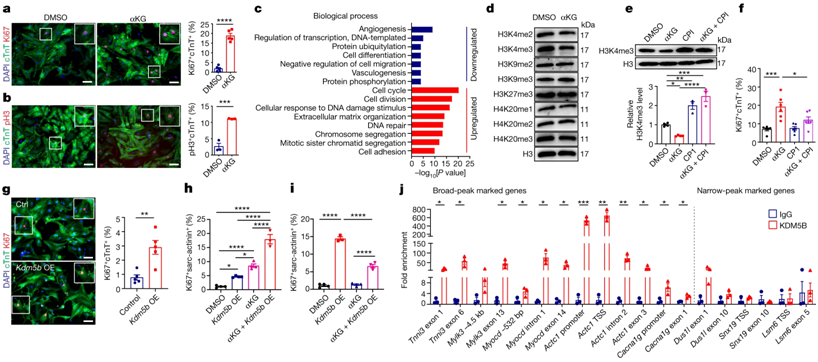
論文共同通訊作者、馬克斯-普朗克心肺研究所主任Thomas Braun領(lǐng)導(dǎo)的一個(gè)研究團(tuán)隊(duì)開始尋找促進(jìn)心臟再生的新方法。論文第一作者Xiang Li和論文共同通訊作者Xuejun Yuan解釋說,“眾所周知,能夠使心臟再生的動(dòng)物物種主要使用糖分和糖酵解作為心肌細(xì)胞的燃料。人類心臟在發(fā)育初期也主要使用糖酵解,但隨后會(huì)轉(zhuǎn)用脂肪酸氧化,因?yàn)樗墚a(chǎn)生更多能量。隨著出生后能量產(chǎn)生的轉(zhuǎn)換,許多基因的活性發(fā)生了變化,細(xì)胞分裂活性也隨之喪失。來自能量產(chǎn)生的代謝物對(duì)調(diào)節(jié)基因活性的酶的活性也有重要作用。因此,我們希望通過重編程能量代謝來引發(fā)基因活性的變化,從而重新開啟心肌細(xì)胞的細(xì)胞分裂能力。”
脂肪酸氧化基因失活
為此,這些作者首先使小鼠體內(nèi)一個(gè)名為Cpt1b的基因失活,該基因是脂肪酸氧化所必需的。Li解釋說,“我們隨后觀察到,這些小鼠的心臟開始重新生長(zhǎng)。”在實(shí)驗(yàn)過程中,這些小鼠心臟中的細(xì)胞數(shù)量幾乎翻了一番。下一步,他們?cè)陉P(guān)閉了Cpt1b的小鼠中引發(fā)了心臟病發(fā)作。
在這種所選擇的方法中,心臟缺血階段之后是再灌注階段,在這一階段中,心臟會(huì)重新獲得含氧血液。Yuan解釋說,“這種模式相當(dāng)于心臟病患者因冠狀動(dòng)脈閉塞而插入支架來治療心臟。效果令人印象深刻:幾周后,心肌中原本常見的瘢痕組織幾乎看不出來了,缺乏Cpt1b的小鼠的心臟收縮能力幾乎恢復(fù)到梗塞前的水平。”
恢復(fù)再生能力
在進(jìn)一步的研究中,這些作者成功破譯背后的內(nèi)在機(jī)制。Braun解釋說,“在基因失活的小鼠心肌細(xì)胞中,我們發(fā)現(xiàn)α-酮戊二酸的水平增加了20倍。高水平的這種代謝物導(dǎo)致 KDM5 酶的活性顯著增加。”
α-酮戊二酸的積累刺激了KDM5活性,減緩了心肌細(xì)胞的成熟,促進(jìn)了心肌細(xì)胞的增殖。圖片來自Nature, 2023, doi:10.1038/s41586-023-06585-5。
這種酶是一種所謂的組蛋白去甲基化酶,它能去除組蛋白中的甲基,從而降低多種基因的活性。這種基因活性的改變會(huì)使心肌細(xì)胞變得不成熟,從而恢復(fù)再生能力。
Braun認(rèn)為這項(xiàng)新的研究是一個(gè)真正的突破。“通過對(duì)心肌細(xì)胞代謝進(jìn)行重編程,我們將心肌細(xì)胞的數(shù)量增加了一倍,而且在心肌梗塞后,心臟功能幾乎可以完全恢復(fù)。”此外,原則上可以通過藥物阻斷 Cpt1b 基因產(chǎn)物 CPT1B的酶活性。開發(fā)一種可用于影響 CPT1B 酶活性的抑制劑,是開發(fā)最終可用于人體的療法的下一步研究工作。
不過,Yuan和Braun強(qiáng)調(diào)說,“要想在人類身上實(shí)現(xiàn)可靠的治療,我們還有很長(zhǎng)的路要走。基礎(chǔ)研究新成果的實(shí)施過程漫長(zhǎng)而昂貴,而且往往伴隨著許多意想不到的問題。盡管如此,我們相信,未來我們將能夠通過治療激發(fā)心臟的再生能力。”





 17312606166
17312606166 加微信獲取對(duì)接
加微信獲取對(duì)接