物種形成是種群進化成新的和獨特的物種的進化過程�,生殖隔離防止種間雜交���,從而保持物種的穩定�。研究生殖隔離的調控機制是認識物種形成的關鍵。然而種間雜交經常導致雜交胚胎無活力和不能正常發育[1],因此雜交中的遺傳不親和性導致的生殖隔離還沒有得到很好的理解�����。熱帶爪蟾(Xenopus tropicalis)和非洲爪蟾(X.laevis)是研究生殖隔離機制的理想模型���。X. tropicalis的卵與X. laevis的精子受精產生的胚胎(te×ls) 無法完成原腸發育并致死; 然而�,以X. laevis為母本雜交產生的胚胎(le×ts) 可以獲得形態正常的雜交個體(圖1)[2]�,美國加州大學Rebecca Heald教授于2018年在Nature發文,發現了爪蟾雜交過程中te×ls染色體3L (ch3L)和4L (ch4L)的大片段DNA缺失�����,并指出父源染色體缺失是雜交胚胎致死和生殖隔離形成的關鍵原因[3]�。


圖1. X. laevis與X. tropicalis雜交胚胎的不同命運
2023年4月7日,中國科學院昆明動物研究所-香港中文大學生物資源與疾病分子機理聯合實驗室趙暉教授團隊與呂雪梅研究員團隊在Science Advances在線發表了題為Modification of Maternally Defined H3K4me3 Regulates the Inviability of Interspecific Xenopus Hybrids的研究論文�����,作者利用這個獨特的種間雜交體系���,進一步研究發現了H3K4me3修飾�����,通過P53信號通路調控胚胎早期發育�,進而決定種間隔離的新機制�,提高了我們對于胚胎發育和物種進化規律的認知。
在本研究中�,作者發現DNA缺失是te×ls和le×ts胚胎發育過程中的一個普遍現象���,在le×ts胚胎中同樣存在大量的小片段缺失�。同時缺失區域基因的低表達可以得到其他兩組同源染色體的表達補償���。此外�����,作者比較了te×ls與其母本X. tropicalis的轉錄差異�,結果發現te×ls的Wnt信號通路顯著下調�����,而P53信號通路顯著上調(圖2)。這一發現與雜交種胚胎發育中的體軸的缺失�、形態發生的失敗以及DNA損傷相一致�����。
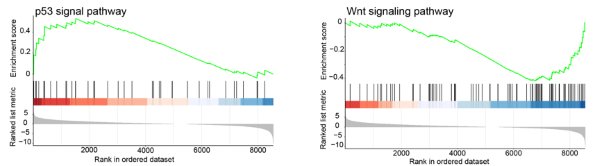
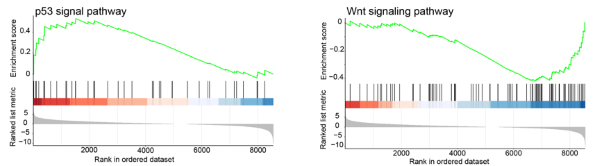
圖2. te×ls雜交物種的Wnt與P53信號通路發生改變
X. laevis是異源四倍體,包含L和S兩個亞基因組。一些研究表明���,表觀遺傳因素在調節亞基因組之間的平衡發揮著重要作用[4]。作者進一步研究發現,te×ls與其母本X. tropicalis具有極低的H3K4me3修飾�,并隨著囊胚期到原腸期的轉化�,H3K4me3修飾水平增加���,與合子基因激活同步�����;然而X. laevis與le×ts胚胎本身具有很高的H3K4me3修飾水平�����,并在原腸期前逐步降低(圖3A-D)。這種異常高的母源H3K4me3修飾���,在之前的研究中發現,可能是X. laevis作為異源4倍體青蛙在長期進化過程中�����,為平衡異源基因組和基因重組丟失而建立的獨特的表觀遺傳修飾機制[5]。作者同時也發現H3K4me3調控Mdm2基因表達�,抑制P53信號通路激活�����;反交胚胎因缺乏H3K4me3修飾���,使得基因組穩態被打破�����,導致DNA缺失引發P53信號通路異常激活和發育停滯�����。并且過表達Mdm2以抑制P53信號通路或通過提高H3K4me3修飾水平,都可以在一定程度上延長雜交胚胎發育階段���,將發育過程從原腸期延續到神經胚(圖3E)。
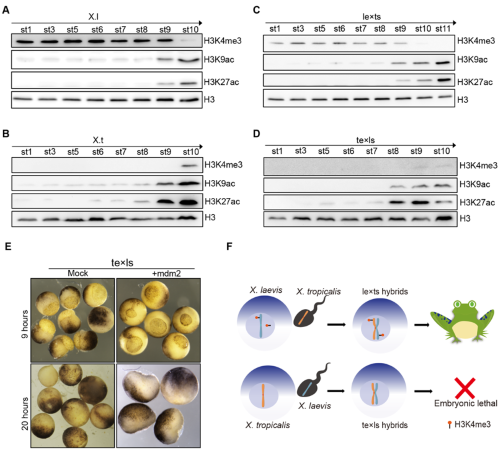
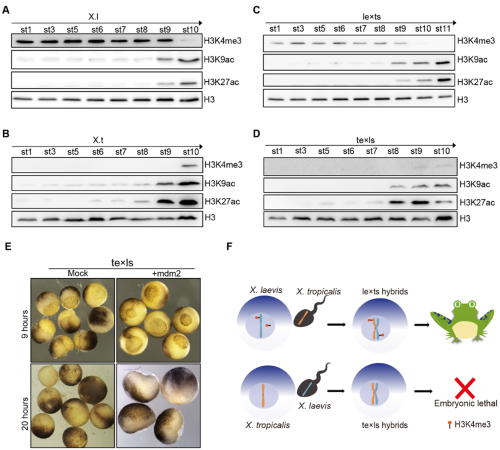
圖3. H3K4me3修飾通過P53信號通路調控生殖隔離機制
綜上所述�,本研究利用兩種爪蟾的獨特的種間雜交體系�����,進一步探討了種間雜交中染色質不親和性的機制。該研究強調了母系定義的H3K4me3修飾,通過P53信號通路調控胚胎早期發育�����,在生殖隔離和維持雜交種亞基因組平衡的重要性(圖3F)�。研究非洲爪蟾雜交種并破譯物種形成的機制將加深我們對生殖隔離、物種進化和調節早期胚胎發育表觀遺傳修飾的理解。
廣州醫科大學生科院龍琪副教授和中國科學院昆明動物研究所博士生閆凱為共同第一作者,香港中文大學趙暉教授與中科院昆明動物研究所呂雪梅研究員為共同通訊作者。該項目得到科技部重點研究計劃�����、國家自然科學基金���、西部之光�����、廣東省自然科學基金等項目的支持。
原文鏈接:DOI: 10.1126/sciadv.add8343
參考文獻:
[1] S. Maheshwari and D. A. Barbash, "The genetics of hybrid incompatibilities," Annu Rev Genet,vol. 45, pp. 331-55, 2011, doi: 10.1146/annurev-genet-110410-132514.
[2] P. Narbonne, D. E. Simpson, and J. B. Gurdon, "Deficient induction response in a Xenopus nucleocytoplasmic hybrid,"PLoS Biol, vol. 9, no. 11, p. e1001197, Nov 2011, doi: 10.1371/journal.pbio.1001197.
[3] R. Gibeaux et al., "Paternal chromosome loss and metabolic crisis contribute to hybrid inviability in Xenopus," Nature, vol. 553, no. 7688, pp. 337-341, Jan 18 2018, doi: 10.1038/nature25188.
[4] D. M. Elurbe et al., "Regulatory remodeling in the allo-tetraploid frog Xenopus laevis,"Genome Biol, vol. 18, no. 1, p. 198, Oct 24 2017, doi: 10.1186/s13059-017-1335-7.
[5] A. M. Session et al., "Genome evolution in the allotetraploid frog Xenopus laevis,"Nature, vol. 538, no. 7625, pp. 336-343, Oct 20 2016, doi: 10.1038/nature19840.





 17312606166
17312606166