既往研究認為,不同物種之間和物種內個體之間的表型差異源于基因表達調控的差異。這是因為大部分基因存在于整個脊椎動物中,且功能保守。現存魚類約有26000多個物種,每個物種是否存在自身特異的基因、發揮何種功能?
TRIM(tripartite motif)家族蛋白是一類E3泛素連接酶,通過泛素化修飾底物參與機體的生命過程調控,包括對天然抗病毒免疫反應的調控。一般來說,在病毒感染后的數小時內,宿主便能激活干擾素反應以抑制病毒的復制;待病毒被清除干凈后,宿主干擾素的表達很快下降,而后維持在很低的本底水平,以避免對組織細胞的更多損傷。為了維持抗病毒反應的“健康”進行,宿主需要實時調控干擾素等細胞因子的適度表達。TRIM基因的數量在不同的脊椎動物中出現了擴張。例如,魚類除了有與人保守的TRIM蛋白外,還有一類特異于魚類的TRIM蛋白,稱finTRIM(fish novel TRIM)。
2019年,中國科學院水生生物研究所張義兵研究團隊在病毒感染的鯽細胞中克隆了一個finTRIM基因。在已有的基因組數據中找不到與該基因有“一一對應”進化關系的同源基因,因而研究認為該基因可能為四倍體鯽特有,命名為FTRCA1(finTRIM C.auratus 1)。FTRCA1在病毒感染時顯著表達,通過降解RLR信號通路中的蛋白激酶TBK1,發揮負調控干擾素抗病毒反應的功能(The Journal of Immunology 2019,202:2407-2420)。
近日,研究證明,FTRCA1是一個E3泛素連接酶,也是一個RNA結合蛋白。FTRCA1負調控宿主干擾素抗病毒反應的機制是:在病毒感染的細胞中,FTRCA1選擇性地與信號分子STING(又稱MITA)和IRF7的mRNA結合,通過RISC(RNA-induced silencing complex)途徑降解mRNA負調控干擾素反應;此外,FTRCA1蛋白還直接結合TBK1蛋白,通過溶酶體途徑降解TBK1蛋白負調控干擾素反應(The Journal of Immunology 2022,209:1335-1347)。該研究解釋了一個物種特異的finTRIM蛋白如何同時獲得RNA結合活性和E3泛素連接酶活性,從RNA水平和蛋白水平兩個層面調控宿主干擾素抗病毒反應的分子機制(圖1)。
FTRCA1介導的這種復雜調控機制不是個例。HERC家族蛋白是另一類E3泛素連接酶。通過比較基因組分析,研究鑒定了一類在哺乳類中丟失了的HERC基因,命名為HERC7亞家族。同樣,HERC7亞家族在不同的魚類物種中也出現不同程度的擴張。對于鯽中的一個HERC7的功能的研究顯示(圖2),鯽HERC7在蛋白水平上降解STING和MAVS蛋白、在RNA水平上降解IRF7的mRNA,通過這兩個途徑負調控宿主的干擾素抗病毒反應(The Journal of Immunology 2022,208: 1189-1203)。
對于物種特異的抗病毒免疫分子機制的研究,將為特定物種的抗病育種提供新思路。研究工作得到國家重點研發計劃、中科院戰略性先導科技專項和國家自然科學基金等的支持。
論文鏈接:1、2
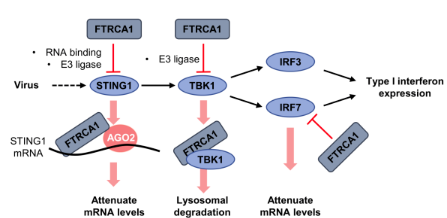
圖1.FTRCA1同時獲得E3酶活性和RNA結合活性調控鯽干擾素抗病毒免疫反應
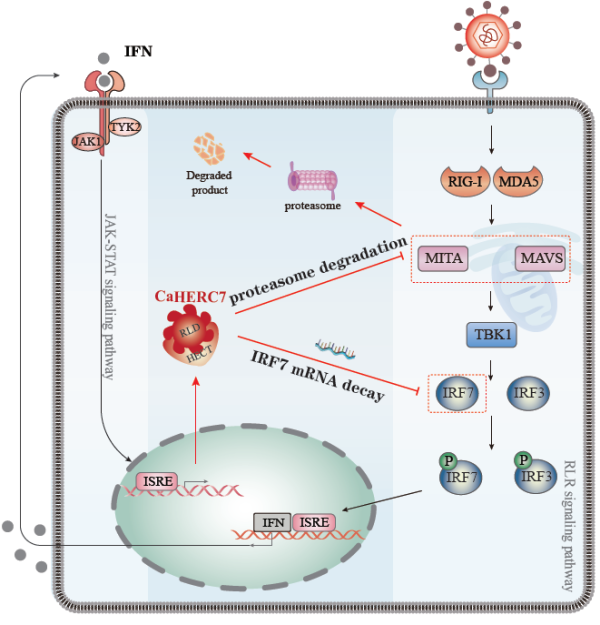
圖2.鯽HERC7在蛋白水平和mRNA水平靶向RLR信號通路分子調控鯽干擾素抗病毒免疫反應





 17312606166
17312606166