摘要:嗅覺喪失(嗅覺喪失)是 SARS-CoV-2 感染的普遍癥狀。 嗅覺喪失可能由非神經元細胞感染和鼻上皮損傷驅動的幾種機制來解釋,而不是嗅覺感覺神經元 (OSN) 的直接感染。我們發現病毒蛋白足以引起硬骨魚嗅覺器官(OO)的神經免疫反應。我們假設SARS-CoV-2刺突蛋白足以引起嗅覺損傷和嗅覺功能障礙。成年斑馬魚模型顯示鼻內注入的 SARS-CoV-2 S RBD 主要與嗅覺器官的非感覺上皮細胞結合,并導致嚴重的嗅覺組織病理學,其特征是纖毛喪失、出血和水腫。然而,在 SARS-CoV-2 S RBD 注入的魚中沒有發現對食物的行為偏好喪失。成年斑馬魚嗅覺器官的單細胞RNA序列表明,支持細胞、內皮細胞和髓系細胞簇中嗅覺受體表達和炎癥反應普遍缺失,同時Treg數量減少。我們的結果表明,鼻內SARS-CoV-2 S RBD足以對斑馬魚嗅覺系統造成結構和功能損傷。這些發現可能對鼻內接種SARS-CoV-2疫苗具有指導意義。
關鍵詞:SARS-COV-2 刺突蛋白 斑馬魚 動物模型 嗅覺損傷 EOG 嗅覺受體表達
簡介:氣味嚴重影響動物的行為和生存。SARS-CoV-2 感染的一個標志是急性嗅覺喪失或嗅覺喪失。雖然大多數報告嗅覺喪失的 COVID-19 患者在發病后 2 周開始嗅覺恢復,但一小部分(~5%)報告稱一個月后持續存在嗅覺障礙。病毒引起的嗅覺喪失并非 SARS-CoV-2 感染所獨有的; 其他呼吸道病毒,如鼻病毒、流感、副流感和季節性冠狀病毒,會導致人類嗅覺障礙。雖然 COVID-19 患者嗅覺喪失的確切機制尚不清楚,但已經提出了一系列潛在的可能原因。 首先,病毒引起的嗅覺喪失可能是由于鼻腔的炎癥性阻塞,COVID-19 患者的嗅上皮 (OE) 中的促炎細胞因子水平升高。在小鼠OE中,I型干擾素的誘導導致嗅覺受體(OR)表達的廣泛喪失,這表明即使在沒有活躍病毒復制的情況下,炎癥也可能導致嗅覺功能障礙。然而,大量 COVID-19 患者報告嗅覺障礙與鼻腔腫脹無關,因此需要進一步研究。其次,支持細胞的 SARS-CoV-2 感染可能會繼發性損害嗅覺感覺神經元 (OSN),從而損害化學氣味信息向嗅球 (OB) 的傳導。在小鼠和人類中,在OB的支持細胞(SCs)、嗅覺干細胞和血管周圍細胞(周細胞)中檢測到ace2表達,但在OSN中未檢測到。此外,在人體活檢中,在嗅覺器官 (OO) 的固有層和 SCs 中檢測到病毒 RNA,表明 OSNs 不經常被感染。此外,用 SARS-CoV-2 感染金黃地鼠會導致大部分 SC 感染,但不會感染 OSN,然而OSN受損,纖毛的大量缺失證明了這一點。綜上所述,SARS-CoV-2感染SCs可能會改變整個OO的局部代謝和炎癥狀態,從而導致OSN受損和隨后的嗅覺缺失。SARS-CoV-2 Spike (S) 蛋白是同源三聚體,每個單體由一個 S1 亞基和一個 S2 亞基組成。S1 亞基包括一個 N 端結構域和受體結合結構域 (RBD)。 SARS-CoV-2 S RBD 與宿主細胞上的血管緊張素轉換酶 2 (ACE2) 結合,然后絲氨酸蛋白酶(如 TMPRSS2)切割刺突蛋白 S1/S2 位點,以促進病毒粒子與宿主細胞膜的融合。一旦 RBD 與 ACE2 結合,就會發生復合物的內吞作用。 一旦進入細胞內,S 蛋白可能會被降解,并且可能會從受感染的細胞中釋放出游離的 S 蛋白片段。事實上,據推測,受感染的細胞和病毒粒子會脫落游離的可溶性 S1 亞基,這些亞基可以結合 ACE2 并導致下游有害作用和炎癥。雖然這一假設需要進一步的實驗支持,但病毒衍生的蛋白質,如來自冠狀病毒和 HIV 的糖蛋白,已被證明可在外周血細胞中誘導 IFN 反應。此外,已經記錄了對病毒蛋白的神經炎癥反應,即使在沒有主動感染的情況下。例如,我們已經證明傳染性造血壞死病毒的糖蛋白(G蛋白)足以觸發硬骨魚的鼻神經免疫反應。基于這項研究,我們假設SARS-CoV-2 S RBD蛋白足以引起嗅覺病理學和功能障礙。斑馬魚的嗅覺系統在分子和解剖學上與人類有很大程度的相似性斑馬魚OO由暴露在外部環境中的兩個獨立鼻孔組成,OSN直接檢測環境水中的化學刺激。鼻孔由許多嗅覺板、指狀結構組成,每一個都覆蓋著非感覺和感覺神經上皮。感覺區由基底細胞、中間神經元前體、成熟的OSN和支持細胞組成,類似于哺乳動物的OE。OSN軸突成束穿過基底層,在固有層形成嗅絲。在固有層中,除了OSN軸突束外,還發現成纖維細胞、膠質細胞和血管。斑馬魚 OO 已在不同的毒物和損傷模型中進行了廣泛研究。斑馬魚 OO 和 OB 的再生能力表明嗅覺恢復的動力學大約需要 2 周; 與在患有嗅覺障礙的 COVID-19 患者中觀察到的相似的恢復時間表。與其他動物模型相比,斑馬魚具有繁殖能力強、發育迅速、維護成本低、身體小而透明等優點。在遺傳學上,超過80%的疾病相關基因具有斑馬魚直系同源基因,并且在斑馬魚基因組中已鑒定出所有主要哺乳動物細胞因子組成員。
一些研究已經提出斑馬魚作為SARS-CoV-2的模型。嘗試通過浸泡感染野生型斑馬魚仔魚表明 SARS-CoV-2 缺乏感染或復制。將SARS-CoV-2病毒微量注射到野生型斑馬魚幼體中,發現在膀胱中有適度復制,通過其他途徑微量注射時沒有復制。利用野生型斑馬魚(仔魚或成魚)來了解SARS-CoV-2感染是有限的。成年硬骨魚OO此前已被證明對來自病原體的蛋白質有反應。在本研究中,我們研究了SARS-CoV-2 S RBD 蛋白在 BSL-1 環境中對斑馬魚嗅覺系統的影響。本研究首次報告鼻內 (I.N.) 注入 SARS-CoV-2 S RBD 足以引起成年斑馬魚的嗅覺病變。損傷是短暫的,因為組織在 2 周內得到修復。 電生理學進一步表明成年斑馬魚在 I.N. 后對氣味的功能反應受損,盡管它們沒有失去對食物氣味的行為偏好。
脊椎動物ACE2分子的比較分析:ACE2 蛋白是人類細胞上 SARS-CoV-2 S RBD 的受體,并在哺乳動物 OE 的支持細胞中表達。脊椎動物血管緊張素轉換酶2(ACE2)分子的比較分析表明,斑馬魚ACE2和人類ACE2之間的相似性分別為72%-73%和57.5%-58%。對SARS-CoV-2 S蛋白結合區域的ACE2氨基酸進行檢測發現斑馬魚ACE2在結合界面處的氨基酸具有適度的保守性。綜合起來,這些數據與之前的報道一致,表明硬骨魚 ACE2 蛋白不太可能與 SARS-CoV-2 S 結合。
SARS-CoV-2 S RBD 的鼻內注入導致成年斑馬魚的嗅覺損傷:嗅覺喪失是人類感染 SARS-CoV-2 的最早表現之一。我們之前已經證明,IHNV糖蛋白足以誘導硬骨魚的快速鼻免疫反應和神經元激活。因此,我們假設重組SARS-CoV-2 S RBD蛋白可能足以損傷斑馬魚的OO。為了驗證這一假設,我們將重組SARS-CoV-2 S RDB注入成年AB斑馬魚的鼻腔,并在3小時(h)、1天(d)、3天(d)、5天(d)和2周(w)后采樣OO。陰性對照包括僅接受賦形劑 (PBS) 注入鼻腔的動物以及接受相同劑量 r-CK12a 的魚。 我們還包括一個 Poly(I:C) 注入組作為 dsRNA 誘導的抗病毒作用的額外對照。在檢查的所有早期時間點,SARS-CoV-2 S RBD 足以對斑馬魚 OO 造成嚴重損害。在注入后3小時,早期組織損傷的特征就是固有層出現水腫和內皮炎癥。注入后1天觀察到嗅板尖端和底部出現出血。在 3 h 時在上皮中觀察到水腫,以組織中的空腔為特征,但到 1 d、3 d 和 5 d 時,在整個固有層發現水腫。此外,通過測量距中縫 50 μm 處固有層的寬度來量化水腫,并發現在 I.N注入 SARS-CoV-2 S RBD后 3 小時和 3 天固有層顯著擴張。注入后1天、3天和5天,觀察到硬骨魚嗅覺上皮的上皮鑲嵌結構缺失。注入后5天在SARS-CoV-2 S RBD注入的動物中觀察到由于嚴重壞死導致的整個嗅板層丟失,而對照動物沒有嗅板層丟失。在所有早期時間點,所有接受SARS-CoV-2 S RBD注入的動物都觀察到嗅板纖毛顯著缺失。接受 r-CK12a 或 Poly(I:C) 的斑馬魚沒有觀察到嗅覺損傷。評估 I.N. 后 OO 的恢復情況。 我們在注入后2周檢查了組織切片。對斑馬魚嗅覺系統可塑性的研究表明,在 OO 化學消融 2 周后,結構和功能得以恢復。在I.N.SARS-CoV-2 S RBD后2周的OO與經賦形劑注入的OO相似。神經上皮鑲嵌修復;沒有水腫,纖毛看起來很健康。這些結果表明,SARS-CoV-2 S RBD足以在斑馬魚OO中造成嚴重但短暫的組織損傷,在缺乏活躍的SARS-CoV-2復制的情況下,可能發生嗅覺損傷。
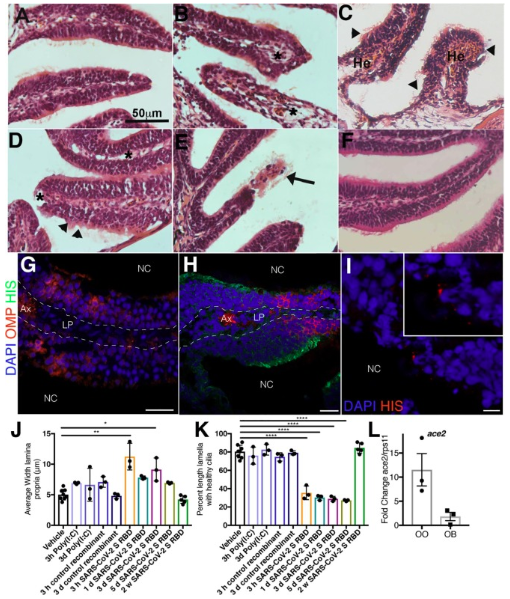
圖1、鼻內注入SARS-CoV-2 S RDB蛋白會對成年斑馬魚造成嚴重的組織學損傷,并在2周后恢復。
為了定位重組SARS-CoV-2 S RBD蛋白與OO之間的相互作用,在SARS-CoV-2 S RBD重組蛋白注入15分鐘后,我們對在成熟纖毛OSN中內源性表達紅色熒光蛋白(RFP)的OMP:lynRFP動物進行了抗His抗體免疫熒光染色。SARS-CoV-2 S RBD蛋白廣泛分布于非感覺上皮,抗-His陽性區域缺乏RFP信號就證明了這一點。此外,野生型斑馬魚在接受SARS-CoV-2 S RBD注入15分鐘后的非感覺區域放大圖顯示,沿著板層的非感覺上皮區域存在有限的點狀抗His染色。SARS-CoV-2 S RBD注入15分鐘的動物的同型對照染色和賦形劑注入動物上的抗-His染色在這些區域均未顯示信號。為了評估斑馬魚同系物ace2是否在斑馬魚的嗅覺系統中表達,通過qPCR測量對照成年斑馬魚的OO和OB上的轉錄水平。我們證實了斑馬魚OO中ace2的中度表達水平,而OB中ace2的表達水平非常低。因此,SARS-CoV-2 S RBD可能與斑馬魚OO中的Ace2相互作用,盡管不能排除配體-受體相互作用的其他機制。
鼻內注入SARS-CoV-2 S RBD改變成年斑馬魚的固有層:根據H&E分析,注入SARS-CoV-2 S RBD后斑馬魚OO 3D固有層中明顯存在大的纖維斑塊。肺組織纖維化是 SARS-CoV-2 和 SARS-CoV 患者的標志,其特征是成纖維細胞持續存在以及膠原蛋白和其他細胞外基質成分的過度沉積。為了確定在斑馬魚固有層中觀察到的變化是否與肺纖維化中發現的變化相似,我們進行了Masson三色染色,將膠原藍染。與對照組相比,SARS-CoV-2 S RBD動物在3小時或3天內藍色染色的膠原蛋白沉積沒有增加。然而,在 3 d 時觀察到大量鮮紅色的沉積物,表明存在于注入動物固有層中的纖維材料由角蛋白組成,可能有助于組織愈合。細胞角蛋白 8 (CTK8) 是斑馬魚再生過程中的表皮標志物。對照成年斑馬魚 OO 中的 CTK8 染色顯示非感覺上皮以及 SCs 和基底細胞中的陽性染色模式。I.N. Poly(I:C)注入沒有改變 OO 中的 CTK8 染色模式。在I.N.SARS-CoV-2 S RBD后3小時,非感覺上皮鑲嵌結構被破壞;祖細胞水平基底細胞通常由扁平形態變圓,柱狀SCs不太明顯。SARS-CoV-2 S RBD后3天,非感覺上皮高度紊亂,固有層的一些細胞中出現CTK8染色,與對照組或固有層CTK8陰性的3小時OO樣本形成鮮明對比。
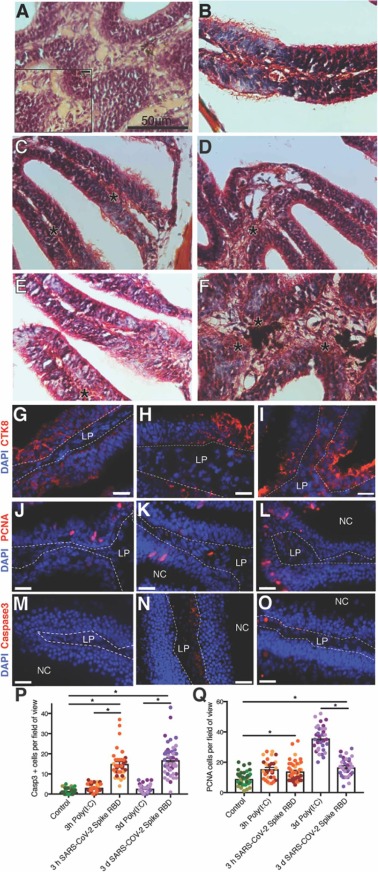
圖 2. SARS-CoV-2 S RDB 蛋白的鼻內注入導致成年斑馬魚 OO 發生嚴重的細胞變化。
我們很好奇CTK8免疫反應模式的這種變化是否是由于固有層和OE受損后OO的細胞動力學改變所致。因此,我們使用抗PCNA抗體來評估處于細胞分裂合成階段的細胞。用同型對照而非抗PCNA抗體染色的OO冰凍切片顯示沒有抗體反應。與賦形劑注入的OO相比,在I.N.SARS-CoV-2 S RBD后3小時和3天,PCNA反應陽性的細胞數量顯著增加。與以往對斑馬魚OO的研究類似,大多數PCNA陽性細胞位于非感覺上皮中,盡管有些細胞位于板層的感覺區。注射SARS-CoV-2 S RBD后3天的PCNA陽性細胞數量與注射病毒模擬物poly(I:C)后3天的PCNA陽性細胞數量不同,這與兩個注入組之間觀察到的組織學差異相呼應。此外,由于 OSN 纖毛的丟失,我們很好奇神經上皮內的細胞是否凋亡。用同種型對照而不是抗激活的 caspase-3 抗體染色的 OO 冷凍切片顯示沒有抗體反應性。我們發現 I.N 后3 小時和 3 天凋亡細胞顯著增加。 SARS-CoV-2 S RBD 在 3 h 和 3 d 時主要位于非感覺上皮細胞中,在 3 d 時一些細胞簇出現在感覺上皮細胞中。在本研究中,與之前在鱒魚中的發現相比,單次注入病毒模擬物poly(I:C)不會導致顯著的細胞凋亡,但三次注入poly(I:C)確實會導致細胞凋亡。
鼻內注入SARS-CoV-2 S RBD會導致嗅覺缺失但不會改變成年斑馬魚的食物偏好:與預注入對食物氣味的反應相比,成年斑馬魚I.N.給予 SARS-CoV-2 S RBD對食物提取物的嗅覺反應瞬間顯著降低,嗅覺電圖記錄 (EOG) 的振幅降低了 50%。暴露于SARS-CoV-2 S RBD后1分鐘內,嗅覺反應降低,表明嗅覺功能發生了瞬間變化。每5分鐘記錄一次對食物氣味的嗅覺反應4秒,持續1小時。在 5 分鐘的間隔期,用水沖洗 OO 以清除多余的氣味并避免過度暴露導致 OSN 脫敏。經 SARS-CoV-2 S RBD 注入的魚對食物提取物的嗅覺反應降低持續 1 小時。對照組動物對食物氣味的反應在任何時間點都沒有減少。這證實了SARS-CoV-2 S RBD注入個體對食物提取物的嗅覺反應降低并非由于過度暴露于食物氣味導致OSN脫敏,而是與OO受損有關。為了進一步量化 I.N. SARS-CoV-2 S RBD引起的嗅覺降低程度,我們利用了斑馬魚中存在的兩個獨立的嗅覺室,將同一動物的一個鼻孔暴露于 SARS-CoV-2 S RBD 蛋白,將同一動物的另一個鼻孔暴露于賦形劑 (PBS) 并等待 3 小時、1 天、3 天或 2 周,然后通過 EOG 測量嗅覺。我們觀察到3小時SARS-CoV-2 S RBD鼻孔對食物和膽汁的嗅覺反應分別比賦形劑注入的鼻孔減少49%和44%,在注入后1天,食物和膽汁嗅覺反應的嗅覺功能分別減少60%和89%。接受SARS-CoV-2 S RBD注入的鼻孔中,一些個體在1天后對膽汁沒有EOG反應。對食物提取物的嗅覺敏感性降低小于膽汁,這可能是由于與食物中發現的氨基酸相比,參與膽汁酸檢測的 OSN 數量較少。SARS-CoV-2 S RBD注入2周后,鼻孔之間的EOG反應沒有差異。與賦形劑注入的鼻孔相比,注入對照重組蛋白(r-CK12a)后3h、1d、3d和2w對食物和膽汁的EOG反應沒有顯著差異。我們的結果表明,EOG 觀察到的 SARS-CoV-2 S RBD 誘導的嗅覺喪失并非特定于 OSN 的一個子集,因為SARS-CoV-2 S RBD 注入的斑馬魚中食物提取物和膽汁嗅覺信號均受到抑制。
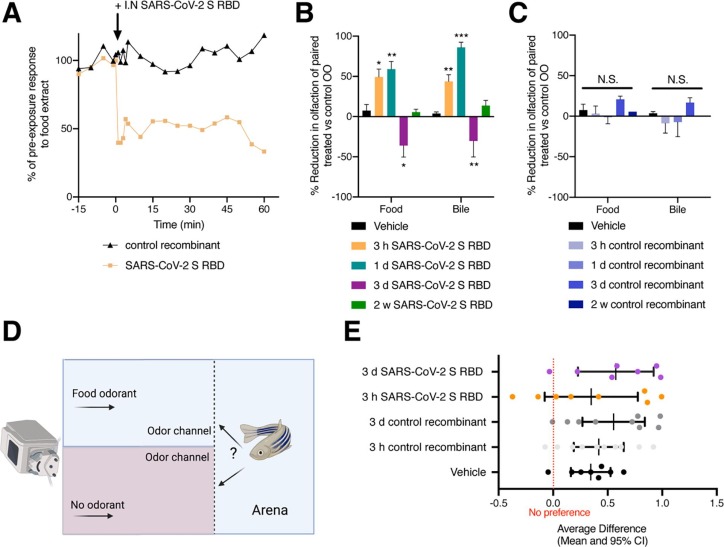
圖 3. SARS-CoV-2 S RDB 蛋白的鼻內注入導致成年斑馬魚嗅覺喪失。
斑馬魚嗅覺器官的單細胞分析:為了更好地了解SARS-CoV-2 S RBD誘導成年斑馬魚嗅覺功能障礙的機制,我們進行了單細胞RNA-Seq(scRNA-Seq)研究。鑒于我們的組織學發現和 SARS-CoV-2 S RBD 與非感覺上皮區域的結合,我們假設轉錄擾動由于間接機制而發生在支持細胞和 OSN 中。在注入SARS-CoV-2 S RBD 3小時或3天后進行scRNA-Seq。我們共鑒定出8個神經細胞簇(NC)、5個SC簇、3個內皮細胞簇(EC)和7個白細胞簇(淋巴和髓細胞)。
鼻內注入SARS-CoV-2 S RBD可誘導成年斑馬魚嗅覺器官的炎癥反應和廣泛的嗅覺受體表達喪失:鑒于從組織學和細胞動力學觀察到的形態變化以及 EOG 對氣味的反應改變,我們假設 SARS-CoV-2 S RBD 治療導致 OSN 的轉錄組變化。斑馬魚 OO 的細胞景觀受到 SARS-CoV-2 S RBD 注入和時間的影響。與對照組和3小時治療組相比,在治療后3天,表達omp的成熟纖毛OSN的比例顯著降低,這在神經元細胞類型的比例中尤為明顯。相比之下,表達細胞周期標志物(aubk、ecrg4和mki67)和神經元分化和可塑性標志物(neurod1、neurod4、gap43、sox11和sox4)的神經元祖細胞在治療后3天擴增。有趣的是,與對照組相比,在從 COVID-19 和甲型流感患者死后人體實質收集的更多單核轉錄組中發現了許多這些可塑性相關的基因。此外,檢測到屬于淋巴細胞2簇的細胞比例顯著下降,該簇在注入重組SARS-CoV-2 S RBD后3小時表達Treg細胞標記物(foxp3b)。在第 3 天,我們觀察到第三個淋巴細胞簇,但在 3 小時未檢測到該細胞簇。該分子在哺乳動物的Th1型免疫反應中具有免疫調節作用。這些結果表明,斑馬魚OO的神經元和免疫細胞亞群對SARS-CoV-2 S RBD有重要的細胞反應。
總之,我們的研究表明,SARS-CoV-2 S1蛋白的一個片段RBD可導致成年斑馬魚的嗅覺病理學和嗅覺喪失。我們的研究結果支持病毒衍生蛋白如SARS-CoV-2 S RBD可能具有神經毒性作用的觀點。本研究提出了與宿主感染 SARS-CoV-2 后 S1 和 S1 衍生蛋白片段的生化相互作用有關的重要問題。如果RBD或其他S1片段在體內釋放,游離病毒蛋白的存在可能會導致或加劇病毒病理生理損傷。進一步的研究可以為這一假說提供實驗支持。
原文出自:Intranasal delivery of SARS-CoV-2 spike protein is sufficient to cause olfactory damage, inflammation and olfactory dysfunction in zebrafish - ScienceDirect





 17312606166
17312606166