近日,中國科學院深圳先進技術研究院賴毓霄團隊在骨缺損治療方向上取得進展。該團隊采用低溫沉積3D打印技術研發出可降解高分子復合黑磷的多功能仿生多孔支架,探究了黑磷支架在植入骨組織中引起的免疫響應功能。該支架可通過調控免疫系統影響免疫微環境,從而有效促進骨缺損修復,具有廣闊的臨床應用前景(如圖)。
相關研究成果以Regulation of Osteoimmune Microenvironment and Osteogenesis by 3D-Printed PLAG/black Phosphorus Scaffolds for Bone Regeneration為題,發表在《科學進展》(Advanced Science)上。骨缺損的治療是臨床上亟需解決的問題。3D打印技術因可制造出具有復雜結構和良好生物相容性的可植入骨支架而在骨科領域備受關注。目前,植入骨支架在與宿主組織結合方面具有挑戰性。在骨支架的設計中,需要考慮骨支架的力學性能和生物相容性以及骨支架在骨再生過程中對免疫反應的調節作用。黑磷作為新型的二維材料,應用于催化能源、光電器件和腫瘤治療等領域。然而,黑磷在骨再生領域尤其是骨免疫微環境調節方面的作用需要進一步研究。該研究使用低溫沉積3D打印技術開發出可降解高分子乳酸-乙醇酸(PLGA)結合黑磷(BP)的多功能仿生多孔支架,并證明了黑磷具有調控巨噬細胞極化以及對骨免疫微環境和骨再生的調節作用。
研究發現,PLGA/BP支架具有良好的生物相容性、生物降解性和力學性能,以及黑磷的降解產物PO43-對骨組織礦化具有重要意義。科研人員觀察到PLGA/BP支架可招募巨噬細胞,促進它們向M2型極化。這種極化狀態有助于抑制骨損傷區早期炎癥反應,并創造良好的骨免疫環境,從而促進骨髓間充質干細胞的分化和骨再生。此外,科研人員通過對人骨髓間充質干細胞(hBMSC)的轉錄組學分析,篩選并證明了PLGA/BP支架可通過激活PI3K-AKT信號通路促進IBSP和SPP1的表達。在體內研究中,科研人員進行了針對類固醇相關性骨壞死(SAON,是由長期使用或短期內大劑量使用皮質類固醇治療引起的常見骨科疾病)大鼠的實驗,過程中伴有嚴重炎癥反應。該研究提出了以臨床挑戰為導向的骨免疫調節和成骨治療方法,即利用適當的骨修復材料對SAON骨缺損進行填充和修復。實驗結果顯示,采用3D打印的PLGA/BP支架可誘導M2型巨噬細胞的增加,促使機體產生適合骨整合的免疫微環境,加速骨組織的形成和修復效果。這表明黑磷支架在骨科領域頗具應用前景,為開發骨修復生物材料在再生醫學應用上提供了有效策略。
研究工作得到國家自然科學基金、中國科學院跨學科創新團隊、廣東省自然科學基金、深圳市自然科學基金基礎研究專項等的支持。
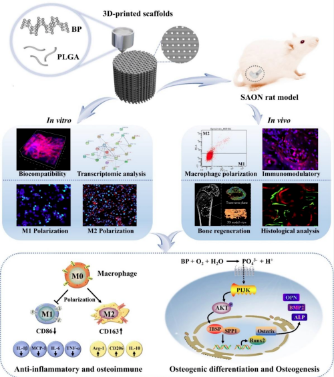
低溫3D打印黑磷支架用于骨免疫調控及促進骨缺損修復的研究路線圖





 17312606166
17312606166