在一項新的研究中,來自美國賓夕法尼亞大學佩雷爾曼醫學院的研究人員發現,一個編碼與tau產生有關的蛋白---TRIM11(tripartite motif protein 11)---的基因可以抑制類似阿爾茨海默病(AD)的神經退行性疾病小型動物模型的惡化,同時改善認知和運動能力。此外,他們還發現TRIM11在消除導致神經退行性疾病(如阿爾茲海默病)的蛋白纏結物方面發揮著關鍵作用。相關研究結果發表在2023年7月28日的Science期刊上,論文標題為“TRIM11 protects against tauopathies and is down-regulated in Alzheimer’s disease”。

阿爾茨海默病是導致老年人癡呆癥的最常見原因,目前估計有 600 萬美國人患有這種疾病。這是一種漸進性腦部疾病,會慢慢破壞記憶和思維能力。
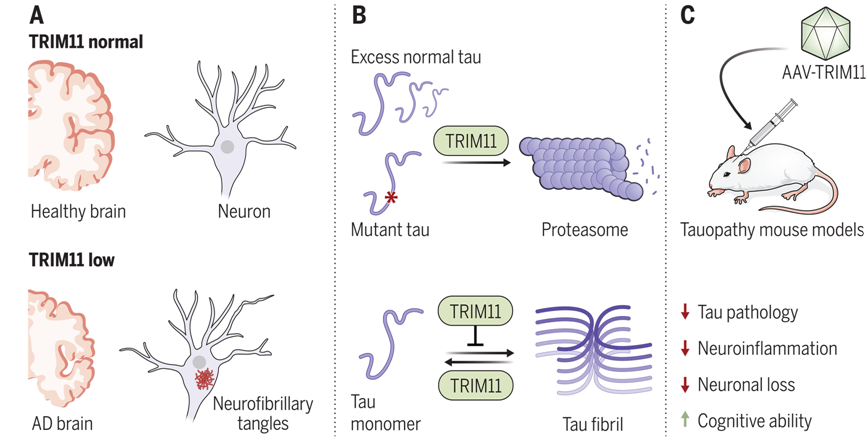
這項新的研究揭示了神經退行性疾病的根本原因之一是 tau 蛋白的神經纖維纏結(neurofibrillary tangle, NFT),這種纏結會導致神經元死亡,從而引發阿爾茨海默病的癥狀,如記憶力減退。
除了阿爾茨海默病之外,由tau 蛋白聚集而成的神經纖維纏結還與其他 20 多種癡呆癥和運動障礙有關,包括進行性核上性麻痹(progressive supranuclear palsy)、皮克病(Pick's disease)和慢性創傷性腦病,它們一起統稱為tau 蛋白病(tauopathies)。然而,這些疾病的患者體內的 tau 蛋白如何以及為什么會聚集在一起并形成構成神經纖維纏結的纖維聚集物仍不清楚。這一重大知識空白使得科學家們在開發有效療法方面面臨挑戰。
論文通訊作者、賓夕法尼亞大學佩雷爾曼醫學院癌癥生物學教授Xiaolu Yang博士說,“大多數生物都有蛋白質量控制系統,可以清除有缺陷的蛋白,防止蛋白錯誤折疊和纏結物積累,就像我們在tau 蛋白病患者大腦中看到的tau蛋白一樣,但是在此之前,我們都不知道這種質量控制系統在人類中是如何發揮作用的,也不知道為什么它會在某些人身上失靈,而在其他人身上卻沒有。我們首次確定了一個監督tau功能的基因,為開發預防和減緩阿爾茨海默病及其他相關疾病進展的治療方法找到了一個有希望的靶標。”
Yang和他的研究團隊,包括論文第一作者、Yang實驗室博士后研究員Zi-Yang Zhang博士,此前已發現TRIM蛋白在動物細胞的蛋白質量控制中發揮著重要作用。在研究了70多種人類TRIM后,他們發現TRIM11在抑制tau聚集方面發揮著重要作用。
TRIM11具有與tau蛋白質量控制相關的三大功能。首先,它與 tau 蛋白結合,尤其是與導致疾病的tau 蛋白突變變體結合,并幫助消除它們。其次,它充當 tau 蛋白的“分子伴侶”,防止蛋白錯誤折疊。最后,TRIM11能溶解已經存在的tau聚集物。
TRIM11在受阿爾茨海默病影響的大腦中的下調及其恢復的潛在治療益處。圖片來自Science, 2023, doi:10.1126/science.add6696。
這些作者利用神經退行性疾病研究中心(Center for Neurodegenerative Disease Research)組織庫中 23 名阿爾茨海默病患者和 14 名健康對照者的死后大腦組織驗證了這些發現,并發現與健康對照者相比,阿爾茨海默病患者大腦中的 TRIM11 蛋白水平大幅降低。
為了確定TRIM11作為治療劑的潛在效用,這些作者使用基因療法中常用的腺相關病毒載體(AAV)將TRIM11基因移植到多個小鼠模型的大腦中。他們發現接受了TRIM11基因的tau病理小鼠在神經纖維纏結的產生和積累方面表現出明顯的下降,認知能力和運動能力也大為改善。
Yang說,“這些發現不僅告訴我們,TRIM11可能在保護人們免受阿爾茨海默病和類似疾病的侵襲方面發揮重要作用,而且我們還看到,未來我們或許能夠開發出為TRIM11水平較低的個體補充TRIM11的療法。我們渴望與我們的同事們合作,探索開發阻止神經退行性疾病進展的基因療法的可能性。”





 17312606166
17312606166