以前每當看到病歷上“轉移性肝細胞癌(HCC)”這幾個字,奇點糕都會覺得頭皮發麻,還有什么比這更符合雪上加霜的定義呢?原發腫瘤就夠難搞了,再疊加上要命的轉移,要不是最近幾年免疫治療有所突破,這類患者的預后就實在差到極點了。
延緩乃至阻斷HCC的遠處轉移,也是許多科研人員和臨床工作者努力的方向。近日,四川大學華西醫院唐紅、周凌云團隊及胡以國團隊與西班牙塞維利亞大學團隊合作,在JournalofExperimental&ClinicalCancerResearch期刊發表了最新研究成果,首次揭示肝癌干細胞(LCSCs)中存在的神經細胞粘附分子(NRCAM)是HCC遠處轉移的關鍵[1]。
研究顯示,NRCAM可以通過細胞骨架分子MACF1介導的β-catenin信號,激活上皮-間質轉化(EMT)及遠處轉移相關的基質金屬蛋白酶(MMPs),從而促進LCSCs的遷移和侵襲,并加速其從腫瘤脫落進入血液循環,導致HCC肝內轉移和肺轉移,對NRCAM及MACF1-β-catenin信號通路進行干預,有望阻斷LCSCs相關的HCC遠處轉移。
既往研究已在卵巢癌、結直腸癌等癌種中確認了NRCAM的高表達,并認定它參與了細胞癌變和細胞運動等過程[2],但還沒有在HCC中開展類似分析,而且NRCAM也和MMPs存在可能的瓜葛,它們會不會都是LCSCs遠處轉移的黑手,必須得查清楚才行。
研究團隊首先開展了單細胞測序,證實HCC中存在較正常肝臟組織顯著更高的NRCAM表達,且TCGA數據庫資料也顯示,NRCAM高表達HCC患者的生存期顯著更短;隨后對146例患者肝臟組織樣本(其中117例為HCC)的分析也得到了相同結論,且已經發生遠處轉移的患者組織樣本中,NRCAM水平還會更高,甚至周邊正常組織中也能檢出。
進一步數據分析還顯示,單獨以NRCAM水平作為HCC診斷標志物的準確性,已接近臨床最常用的甲胎蛋白(AFP)以及異常凝血酶原(PIVKA-II),三者聯合使用時受試者工作特征(ROC)曲線下面積(AUC)為0.91,且NRCAM單獨或聯合使用,預測HCC遠處轉移的效能同樣尚可(AUC0.70,聯合使用時為0.75),可用于識別早期轉移風險高的患者。
這兩步分析一做,NRCAM與HCC遠處轉移的關系就八九不離十了,研究者們還專門用HCC類器官實驗再做了確證,并發現高表達NRCAM的HCC還同時具有干細胞樣特征,如WNT/β-catenin信號通路、EMT相關基因的表達水平上升等。
接下來,研究團隊把目標縮小到LCSCs身上,專門分析NRCAM對這部分“頑敵”的影響:轉錄組學分析顯示,高表達NRCAM的LCSCs往往同時存在MYC基因激活,二者表達水平正相關,且有WNT/β-catenin信號通路和EMT相關基因的高表達,此外還能檢測到MMPs中的MMP3/7/14激活,這些關鍵基因和信號通路的激活大多經由MACF1介導。
3D類器官實驗則顯示,向LCSCs中轉染MYC基因并使它們高表達NRCAM后,LCSCs遷移速度就大幅加快;將類器官移植到免疫缺陷小鼠身上后,腫瘤很快就發生了肺轉移,足足占據了小鼠肺部的16%,是對照組的10倍還多,說明LCSCs的肺轉移能力極強;肝內原發腫瘤也有相似的趨勢,占據肝臟的體積是對照組的約5倍。
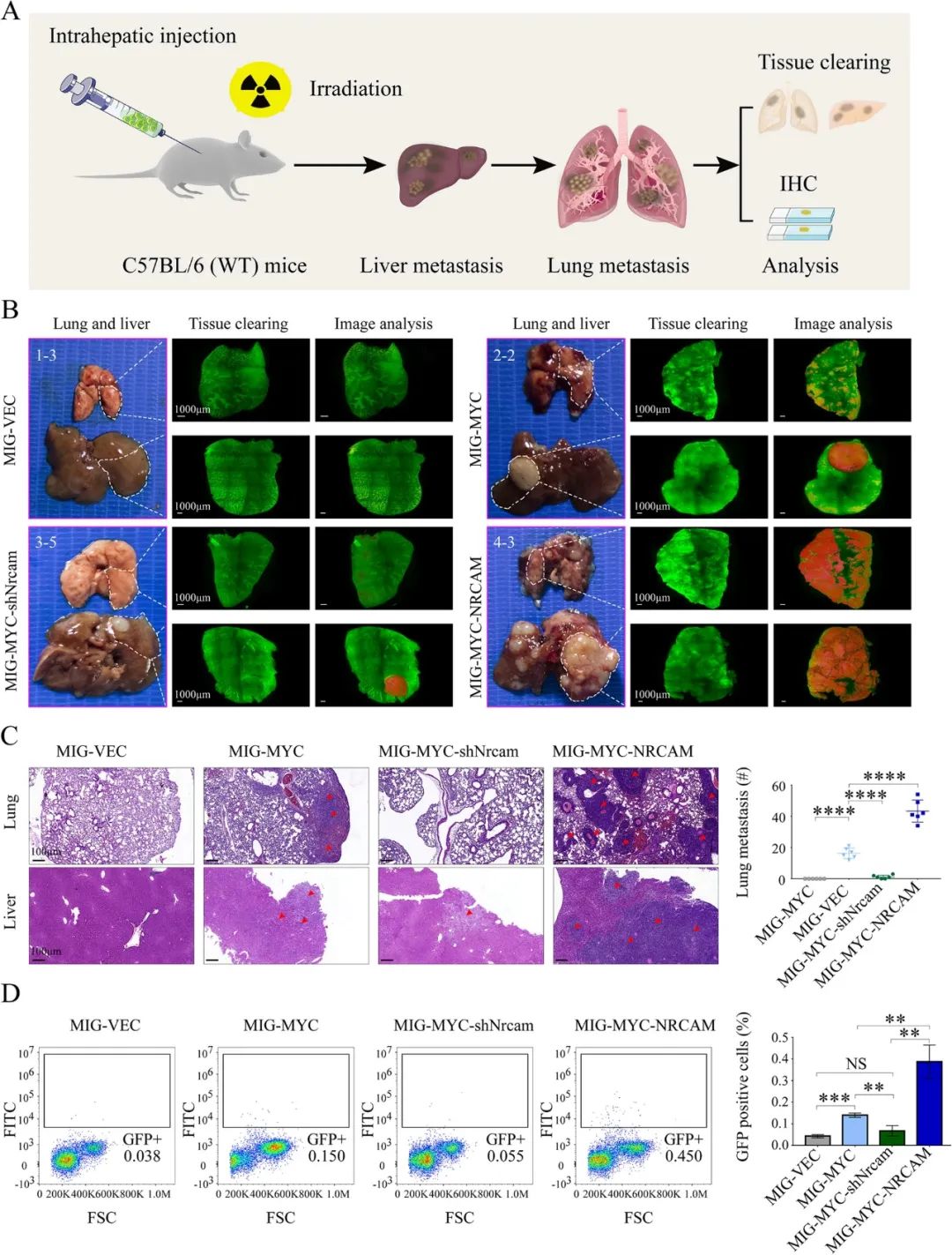
高表達NRCAM且MYC激活的LCSCs類器官肺轉移能力極強
研究者們將本次研究的意義總結為兩方面,一方面是以NRCAM作為血檢標志物,用于HCC的確診和發現遠處轉移,乃至預測早期HCC患者的遠處轉移風險,但這還需要更大樣本量的前瞻性研究來進一步證實;另一方面就是對NRCAM、MACF1或β-catenin通路展開治療性干預,降低LCSCs導致的HCC遠處轉移風險。





 17312606166
17312606166