在這項研究中,研究者們發現了與自閉癥密切相關的MEF2C基因上一個新的致病位點p.L35P。在這個位點上發生突變的小鼠產生了與自閉癥相似的癥狀。隨后,研究者們開發了一款能夠直接編輯單個堿基的基因編輯器,將其嵌入病毒外殼中并給基因突變的小鼠注射,使突變的基因成功得到糾正,改善了小鼠的自閉癥行為。

2023年11月27日,上海交通大學醫學院松江研究院/中國科學院腦科學與智能技術卓越創新中心(神經科學研究所)仇子龍團隊與復旦大學腦科學轉化研究院程田林團隊合作在國際神經科學權威期刊《自然·神經科學》(NatureNeuroscience)上發表題為《全腦體內基因編輯逆轉了Mef2c變異小鼠的行為變化》(Whole-braininvivobaseeditingreversesbehavioralchangesinMef2cmutantmice)的研究論文,首次報道了在全腦范圍內利用單堿基編輯技術成功改善Mef2c自閉癥小鼠模型神經發育與自閉癥樣核心行為表型。
在這項研究中,研究者們發現了與自閉癥密切相關的Mef2c基因上一個新的致病位點p.L35P。在這個位點上發生突變的小鼠產生了與自閉癥相似的癥狀。隨后,研究者們開發了一款能夠直接編輯單個堿基的基因編輯器,將其嵌入病毒外殼中并給基因突變的小鼠注射,使突變的基因成功得到糾正,改善了小鼠的自閉癥行為。
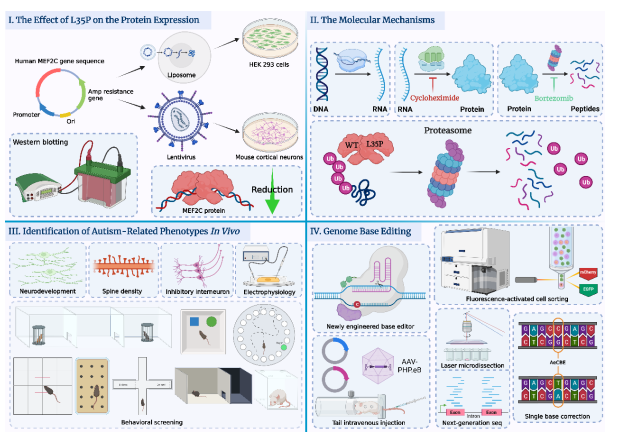
圖I:L35P點突變顯著降低MEF2C蛋白表達水平。
圖II:L35P點突變通過泛素化蛋白酶體降解途徑介導MEF2C蛋白翻譯后快速降解。
圖III:Mef2cL35P雜合小鼠表現出與孤獨癥相關的異常神經發育,突觸密度降低,抑制性中間神經元數量下降及異常的電生理表型,且出現孤獨癥相關的行為學表型。
圖IV:基于CRISPR/Cas9系統開發的新型胞嘧啶單堿基編輯系統,通過體內及體外驗證了其在目標靶點的堿基編輯效率以及脫靶事件,證明該系統是高效,準確且安全的。
圖片來源:《自然·神經科學》
“目前,自閉癥的治療是醫學中的難點之一,尚沒有特效藥能夠治療自閉癥。”對于該研究,上海科技大學的朱俊杰博士與陳佳研究員評論道,“這項研究證明了體內堿基編輯在神經發育障礙治療中的潛力,同時也為其他類型的堿基編輯器在腦內遞送以及編輯帶來了新的啟發。”
p.L35P基因突變或導致自閉癥
自閉癥譜系障礙(AutismSpectrumDisorder,簡稱ASD),是一類嚴重影響兒童身心健康的神經發育疾病,患者表現出嚴重程度不同的社交障礙以及重復刻板行為。
根據美國疾控中心統計,自閉癥的發病率呈逐年升高的趨勢,2022年美國自閉癥患病率約為1/361。中國對于6-12歲自閉癥兒童患病率的統計顯示,男孩約為0.44%-0.95%,女孩約為0.12%-0.30%。
自閉癥與先天和環境條件密切相關,而基因被視為重要因素之一。近年來研究者們發現了數百種自閉癥風險基因及致病基因突變,包括與神經粘著分子、離子通道蛋白等神經細胞中的各種蛋白質表達相關的基因。其中,Mef2c基因已被證實是一個很重要的自閉癥風險基因,突變會導致神經發育遲滯及一系列嚴重癥狀。
“有研究結果表明,Mef2c基因在成年小鼠的大腦皮質、海馬體和杏仁核中大量表達,其能夠調節突觸可塑性和谷氨酸能突觸的數量,是ASD相關基因網絡的調節基因之一。Mef2c的突變會導致兒童大腦發育缺陷,其特征為精神運動障礙,缺乏言語,異常運動模式等。”朱俊杰博士與陳佳研究員評論道。
一段具備特定功能的基因序列中的單個或多個堿基變化都可能對功能產生影響。在本研究中,仇子龍研究團隊通過全外顯子組測序技術在一例中國的自閉癥患兒的Mef2c基因上發現了一個新發點突變(denovomutation),c.T104C,p.L35P。這個新發點突變對于Mef2c基因功能的影響未知。
為了研究該位點對Mef2c的影響,研究團隊首先利用分子細胞生物學的研究方法在體外探究了L35P點突變對Mef2c蛋白結構、表達以及功能上的影響及其分子機制。研究團隊發現L35P突變會導致Mef2c蛋白質發生依賴泛素化蛋白酶體途徑的快速降解,最終顯著降低Mef2c蛋白的表達水平。
隨后,研究團隊構建了Mef2cL35P點突變敲入小鼠模型,并通過生物化學、免疫熒光成像以及行為學實驗探究了其神經發育及行為學表型。研究發現Mef2cL35P雜合突變小鼠大腦中存在自閉癥相關的神經生理學特征以及發育異常現象,并且表現出社交障礙以及刻板行為等自閉癥核心癥狀的行為學表型。
體內基因治療修復小鼠變異
目前研究多集中在基因突變導致自閉癥的分子與環路機制上,是否可以運用基因編輯方法對導致自閉癥的基因突變在大腦內進行準確的修復還未見報道。在本研究中,研究者們使用首次使用基因編輯修復了自閉癥小鼠神經元中L35P的基因突變。
CRISPR/Cas9系統是細菌和古細菌在不斷進化的過程中產生的適應性的免疫防御機制,通過這一系統細菌能夠識別并剪切外來的噬菌體和病毒的DNA。在其基礎上,科學家們開發出了一套基因編輯系統,使得精確高效的基因編輯成為可能。這項技術的風險之一在于,CRISPR/Cas9可能會與不是目標序列的DNA產生錯配,進而導致非預期的基因突變,這被稱為“脫靶效應”。
在本研究中,仇子龍和程田林團隊合作開發了一種基于CRISPR/Cas9的新型胞嘧啶單堿基編輯系統(APOBEC3AembeddingCytosineBaseEditor,AeCBE,已申請相關發明專利),使其能夠將小鼠Mef2c基因中特定位置上異常的C·G堿基對轉換成正常的T·A堿基對。
為了能夠使得新型CBE系統成功地跨越小鼠血腦屏障(bloodbrainbarrier,BBB),研究團隊將AeCBE系統包裝進PHP.eB血清型的腺相關病毒(Adeno-associatedvirus,AAV)中,并且利用單次小鼠尾靜脈注射AAV的遞送方式,使得AeCBE系統在小鼠大腦中多個腦區得以成功表達。經AeCBE系統編輯后,研究團隊在體內檢測到較高的單堿基編輯效率以及低脫靶事件,驗證了新開發的AeCBE系統具備高效性、準確性且安全性的特點。
最后,研究團隊檢測了經過AeCBE系統介導的基因治療后Mef2cL35P突變雜合小鼠大腦中的神經生理學變化以及行為學表型。在經過單堿基編輯技術介導的基因修復后,研究團隊發現Mef2cL35P突變雜合小鼠大腦中降低的Mef2c蛋白表達水平得到恢復,并且其社交障礙以及重復刻板性行為也得到了明顯的改善。
這項研究成果表明基因編輯技術有望為腦部遺傳疾病患者帶來福音。“近年來,堿基編輯技術已廣泛應用于生命科學的眾多領域,特別是基于血紅蛋白病、早衰癥、視網膜病變、神經肌肉病、心肌病、耳聾等疾病的基因治療。”華東師范大學李大力教授說,“這項研究通過在體全腦堿基編輯首次實現了自閉癥小鼠的有效治療,為自閉癥治療提供了新的思路,并進一步表明了堿基編輯技術治療遺傳性腦部疾病的巨大潛力。”
“在未來,對于腦部遺傳病的基因治療還可以有更多優化選擇策略,比如針對需編輯的致病位點多樣性而使用編輯范圍更廣的工具,使用更精準和親和的遞送方式等。除CBE之外,ABE編輯系統以及近期報道的多個基于ABE系統TadA脫氨酶進化得到的新型CBE、CGBE、ACBE等編輯工具均有望在遺傳疾病的治療中得到應用。”北京大學的牛煦然博士和魏文勝教授評論道。
參考文獻:
https://www.nature.com/articles/s41593-023-01499-x
(原標題:上海團隊發現自閉癥新基因位點,首次用基因編輯改善小鼠自閉行為)





 17312606166
17312606166