小鼠植入前胚胎的早期卵裂球具有雙電位細胞命運,能夠在胚泡中產生胚胎和胚胎外系。在這里,作者鑒定了三種主要的兩細胞階段(2C)特異性內源性逆轉錄病毒(ERVs)作為這種雙潛能可塑性的分子標志。利用這三種2c特異性erv的長末端重復序列(ltr),作者發現Kruppel-like factor 5 (Klf5)是它們主要的上游調節因子。
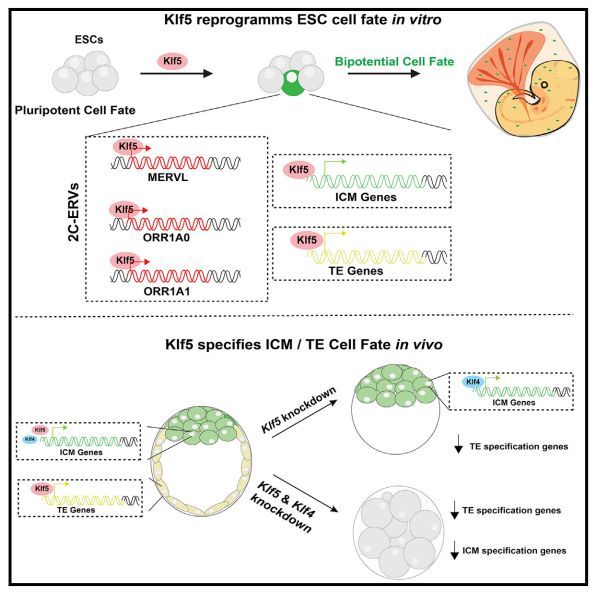
Klf5對雙電位細胞命運至關重要; 一個Klf5過表達的胚胎干細胞(ESC)在嵌合胚胎中產生終末分化的胚胎和胚胎外系,Klf5直接誘導內細胞質量(ICM)和滋養胚層(TE)規范基因。有趣的是,Klf5和Klf4在ICM規范中冗余地發揮作用,而僅Klf5缺陷就會損害TE規范。Klf5受到多個2c特異性轉錄因子的調控,尤其是Dux,并且Dux/Klf5軸是進化保守的。2c特異性轉錄程序與Klf5匯合,建立雙電位細胞命運,使ICM和TE基因雙重激活的細胞狀態。

圖片來源:https://doi.org/10.1016/j.celrep.2021.109982
哺乳動物著床前發育是由母體遺傳因素和合子基因組激活過程中轉錄的合子基因啟動的。小鼠受精卵和兩細胞階段(2C)卵裂球是全能的,能夠產生可育的成年有機體所需的所有細胞類型。全能性在隨后的發育階段逐漸受到限制,但分裂期卵裂球保留雙勢細胞命運,產生內細胞團(ICM),主要形成胚胎本身,滋養外胚層(TE),產生胚胎外胎盤組織。
雙電位細胞命運的一個顯著分子標志是強烈但短暫的內源性逆轉錄病毒(ERVs)誘導。MERVL轉錄本是2C - 4C胚珠轉錄組中表達量最高的轉錄本之一; 在發育過程中,隨著卵裂期卵裂球的發育可塑性變窄,其水平迅速下降。在多能小鼠胚胎干細胞(ESCs)中,產生所有的胚胎細胞類型,但很少產生胚胎外系,在罕見的細胞群中誘導MERVL通常與擴大的細胞命運可塑性相關,使分化向胚胎和胚胎外系。
然而,這樣的MERVL+ ESCs并不等同于2C的卵裂粒,既不具有全能的細胞命運潛能,也不具有2C的轉錄組。相反,在作者的研究中,MERVL+ ESCs,即雙潛能ESCs,表現出胚胎和胚外潛能,在中等水平誘導MERVL,并在功能上類似于雙潛能胚珠,其發育潛力比2C胚珠更受限。
由于MERVL是2C胚珠的一個分子標志,人們推測直接調控MERVL并在ZGA處短暫峰值的轉錄因子可以建立一個轉錄景觀,從而實現雙電位細胞命運。雙homeodomain轉錄因子Dux就是這樣一個候選因子,它在ZGA開始時誘導2C胚珠中直接促進MERVL的表達。合子表達的Dux及其母系遺傳的上游調控因子Dppa2、Dppa4、Nelfa和Smarca5被推測在轉錄層次的頂層發揮作用,這些調控因子控制著ZGA的發生、MERVL的誘導和2c特異性細胞命運潛能的調控。
然而,單獨使用Dux、Smarca5或Nelfa,或Dppa2和Dppa4聯合使用,均不能損害小鼠ICM或TE的特異性,這表明這些因素對建立/維持雙潛能細胞命運并不重要。因此,使用MERVL作為雙電位細胞命運的唯一分子標記可能不足以識別雙電位細胞發育命運的關鍵調控因子
lf5通過對ICM和TE基因的雙重調控,建立了雙電位細胞命運
圖片來源:https://doi.org/10.1016/j.celrep.2021.109982
通過使用三種2c特異性erv作為雙電位細胞命運的標志,我們發現克虜伯樣因子(Klf5)是賦予胚胎和胚胎外系發育潛力的重要調控因子。雖然之前的研究已經描述了Klf5敲除胚胎的著床前缺陷,但Klf5在雙電位細胞命運中的功能重要性,以及Klf5與其他Klf轉錄因子在著床前發育中的功能相互作用在很大程度上仍不清楚。
作者的研究表明,Klf5在一個單一的、多能的ESC中過表達,在嵌合胚胎中賦予雙電位細胞命運。小鼠遺傳學研究表明,Klf5在促進TE規范方面發揮了重要作用,Klf5和Klf4在賦予ICM細胞命運的效力方面發揮了冗余作用。由于Klf5直接誘導ICM和TE基因,該數據表明,雙潛能發育潛能的分子本質是一種共同表達ICM和TE基因的細胞狀態。





 17312606166
17312606166