補體系統是先天免疫系統的一部分,主要功能是通過溶胞,吞噬及介導炎癥反應來清除入侵的病原體。人體內的補體蛋白總量高達1.5x10^19個,主要分布在血液、組織液中及細胞膜表面,構成了機體的一道免疫長城。自19世紀末發現補體以來,科學家們對補體系統的研究及補體藥物的開發從未中斷過,然而首款補體藥物直到2007年才由Alexion研發成功,迄今為止補體領域上市的新藥仍然屈指可數。去年12月阿斯利康壕擲390億美元收購了Alexion,引發了業內對補體藥物的強烈關注,此外Novartis、Sanofi等業界大佬近幾年也各出奇招,通過并購或自身研發紛紛進入補體領域,欲從中分得一杯羹,補體藥物開發正當時......
補體簡介
補體蛋白在胎兒發育的前三個月便開始產生,到出生時,補體系統就已經發育完成。補體通過溶胞、吞噬及介導炎癥反應來清除免疫復合物,表現出相應的生物學功能。補體蛋白通常是共同發揮作用消滅病原體,并能向其他免疫系統成員發出開始進攻的信號[1]。補體只有被激活后才具有生理活性,補體激活有三條途徑,根據起始分子的不同,分為經典途徑(免疫復合物啟動)、凝集素途徑(糖組分啟動)和旁路途徑[2]。

圖1 補體激活的三種途徑
3種激活路徑的前端反應各異,但末端通路相同,即攻膜階段。在攻膜階段,C5在C5轉化酶的作用下裂解為C5a和C5b,其中C5b與其他補體蛋白(C6、C7、C8和C9)結合,形成膜攻擊復合物(membrane attack complex,MAC)。插入細胞膜上的MAC形成親水性穿膜孔道(內徑約10~11nm),能使水和電解質通過,而不讓蛋白質類大分子逸出。最終由于胞內滲透壓降低,入侵的病原體腫脹破裂走向滅亡。

圖2 膜攻擊復合物的形成
補體激活是機體免受感染的一種快速保護機制,但補體失效或過度激活也會導致多種疾病,如缺血性中風、膿毒癥等急性炎癥,牙周病、眼部疾病等慢性炎癥,紅斑狼瘡等自身免疫性疾病[3]。此外,一些腫瘤、腎病、神經退行性疾病、慢性溶血、血栓性微血管病等也與補體系統異常有關[4]。
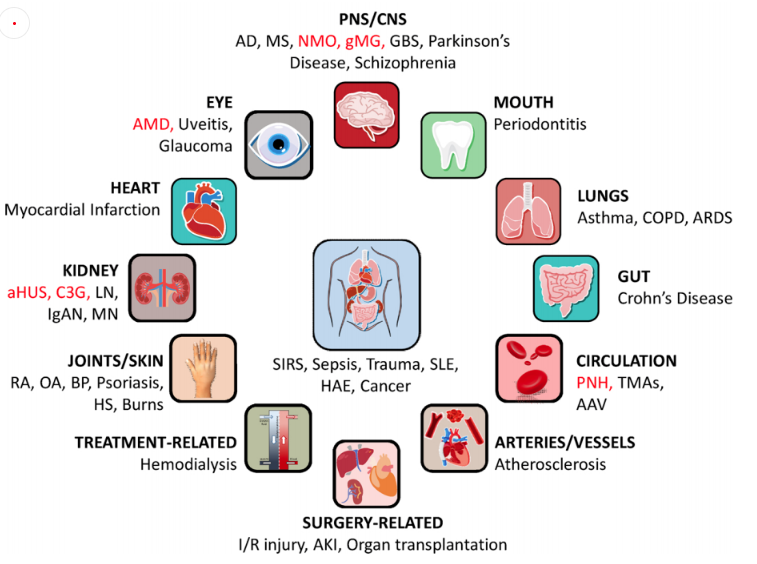
圖3 與補體系統有關的疾病
補體系統除補體固有成分外,還有一系列的補體受體蛋白和補體調節因子。補體受體廣泛存在于不同細胞膜的表面,是細胞表面的重要膜結構,如C3a的受體C3aR,C5a的受體C5aR1、C5aR2。其中有關C3aR和C5aR的研究最為深入,被發現與多種癌癥密切相關[5]。補體調節蛋白廣泛存在于血漿和細胞膜表面,可通過調節補體激活途徑中的關鍵酶從而控制補體激活的強度和范圍,分為可溶性調節蛋白和膜結合蛋白兩種。
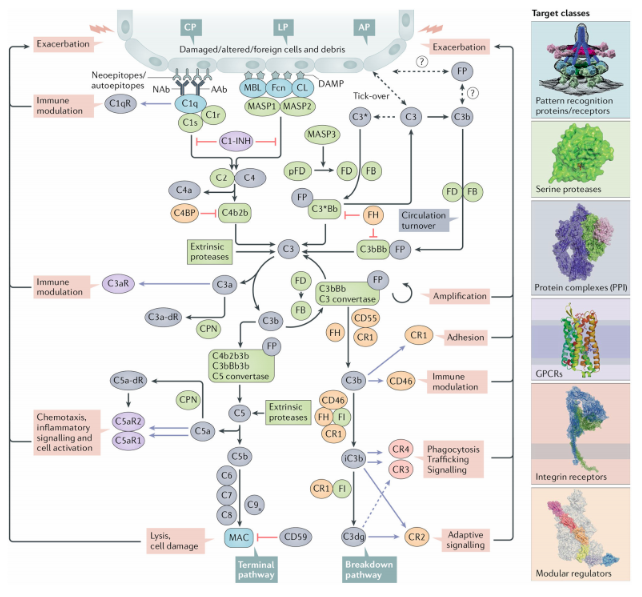
圖4 補體與受體及調節因子的作用關系
補體藥物研究現狀
人體內的補體蛋白共約1.5x10^19個,占血清總蛋白的10%,且代謝速度極快,半衰期平均只有幾分鐘。如此天量且代謝迅速的補體蛋白是機體免疫系統強大的保證之一,也是補體藥物開發面臨的巨大阻礙,補體藥物往往需要高頻率和大劑量才能起到阻斷效果。此外,機體有一套復雜精密的調控網絡來維持補體系統的正常運轉。即使阻斷其中一條補體通路,補體系統也能通過調節機制激活其他通路,保護機體不受病原體侵襲,但這也容易導致靶點藥物失效。
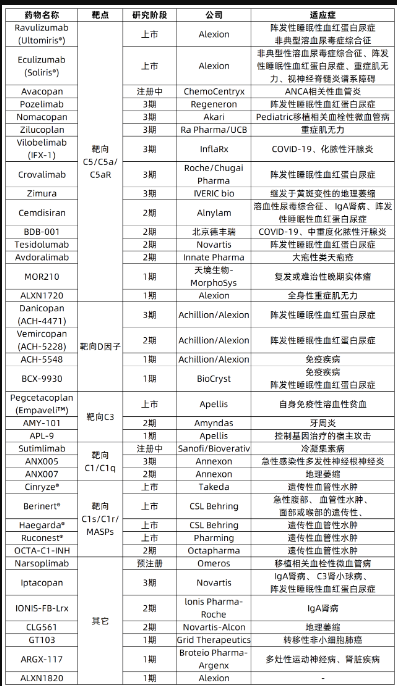
迄今為止,上市的補體藥物只有寥寥幾款,遠不能滿足市場需求。據不完全統計,截至2021年8月,共有7款上市藥物,3款在/預注冊候選藥物,27款處于臨床階段的藥物;靶點方面,靶向C5及其相關受體的藥物最多,有15個;藥物類型方面,抗體藥最多,共18個,小分子其次,共9個。詳見下表:
補體研究小鼠
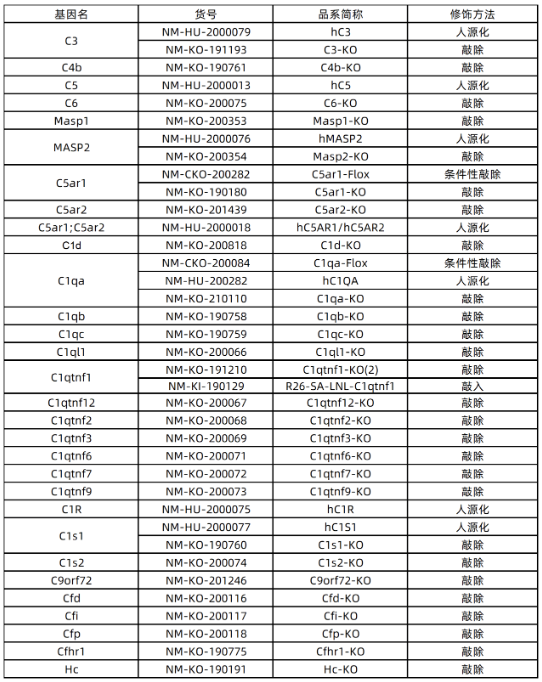
南模生物自主開發了多種補體、補體受體、補體調節因子的敲除、條件性敲除和人源化小鼠模型,為補體相關的基礎研究,藥物篩選,藥理藥效研究提供了合適的工具,詳細模型信息見下表:
南模生物深耕基因編輯領域,提供全方位模式生物服務,包括基因修飾成品模型供應、個性化模型定制、飼養繁育、表型分析、藥效評價等,滿足不同實驗室需求。
Reference:
[1]How the Immune System Works.6th Edition,by Lauren M. Sompayra
[2]Brain. 2019 Nov 1;142(11):3325-3337. doi: 10.1093/brain/awz222.
[3]Mol Immunol . 2019 Oct;114:341-352. doi: 10.1016/j.molimm.2019.07.030. Epub 2019 Aug 22.
[4]J Clin Invest . 2020 May 1;130(5):2152-2163. doi: 10.1172/JCI136094.
[5]Nat Rev Drug Discov. 2019 September ; 18(9): 707–729. doi:10.1038/s41573-019-0031-6.





 17312606166
17312606166