目的基因過表達,是研究基因功能的主要方法之一。其中,如何確保目的基因準確無誤的表達是非常關鍵的一步。因為目的基因表達過量或者在不恰當的時間表達都會影響到細胞狀態或者機體的生長發育,進而影響實驗結果。四環素(Tetracycline, Tet)調控基因表達系統便可以做到對基因表達的精準調控,今天小編便來介紹這一神奇的基因開關。
四環素調控基因表達系統
四環素調控基因表達系統是以大腸桿菌Tn10轉座子上Tet抗性操縱子為基礎而建立的。在細菌系統中,正常情況下,tetR將與tetO結合,抑制下游抗性基因的轉錄。當存在四環素或者四環素類似物如強力霉素時,tetR將與四環素結合,不再和tetO結合,造成下游抗性基因表達,細菌從而獲得耐藥性[1]。
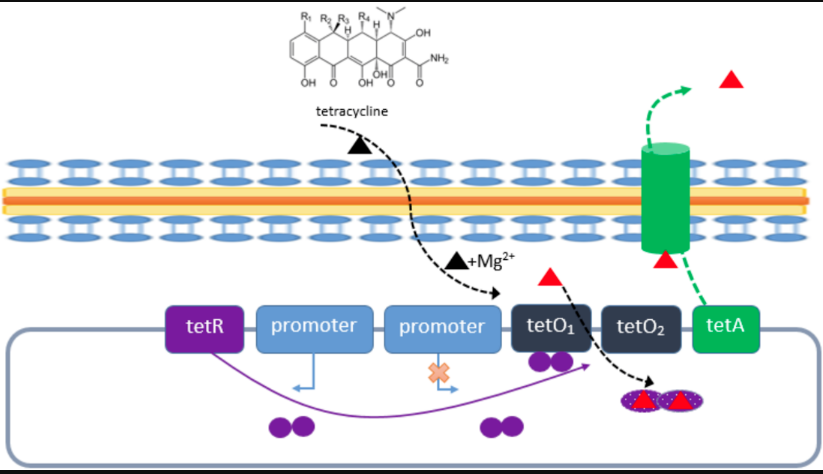
圖1 TetR和tetO在四環素耐藥菌中的作用原理[1]
注:在沒有四環素的情況下,TetR(紫色實心圓)以高親和力與兩個四環素操縱子tetO1和tetO2 結合。這導致四環素外排轉運蛋白 TetA 的抑制。如果存在四環素時(黑色三角形),四環素與 Mg2+形成復合物(紅色三角形)。該復合物與 TetR 結合,這導致TetR 與tetO分離,TetA得以表達。
由此可見,四環素誘導基因表達系統的關鍵元件是四環素反應元件(TRE)和四環素阻遏蛋白(TetR)。經過多年發展,這一系統也經過了多次優化,現在常用的TRE是由7個長度為19個氨基酸的四環素抗性操縱子(TetO)組成,TRE及下游CMV啟動子共同組成了四環素依賴性啟動子(Ptet)。而對TetR的改造,使得多種Tet調控系統逐漸發展起來,應用最為廣泛的便是抑制型系統Tet-off和激活型系統Tet-on。
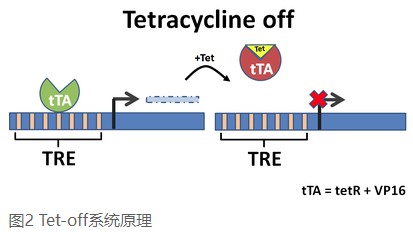
Tet-off系統
Gossen 和Bujard最初構建的系統便是Tet-off系統,即在四環素存在的情況,目的基因表達水平降低或者不表達。為了達到這一目的,人們對大腸桿菌TetR進行了改造,將皰疹病毒的 VP16 蛋白的轉錄激活區域融合到TetR上,從而合成了反式激活蛋白tTA,改變了TetR阻遏蛋白的屬性。在缺乏四環素時,tTA 將和TRE結合,VP16會使Ptet活化從而使基因表達促進目的基因表達,而在四環素存在時,tTA則與四環素結合,抑制目的基因表達[2]。
Tet-on系統
1995年,Gossen等發現了tetR參與四環素誘導的抑制反應的關鍵的4個氨基酸殘基,這些氨基酸殘基突變后可發生反向的反應,即在四環素存在的條件下,目的基因能夠表達蛋白,而缺失四環素時,目的基因無法表達。新的反式激活蛋白被稱為rtTA,由rTetR與VP16融合而成[2]。
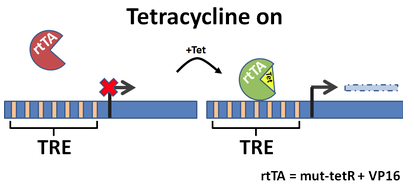
圖3 Tet-on系統原理
經過多年的發展,人們對Tet-on系統的啟動子和活化因子進行了持續的優化,使目的基因在沒有四環素的情況下表現出更高的穩定性和更低的背景活性,在有四環素誘導情況下有更高的表達水平。其中,TRE3G和rtTA2 S -M2 變體表現出對四環素的高敏感性,成為目前廣泛應用的四環素誘導系統的元件[3][4]。
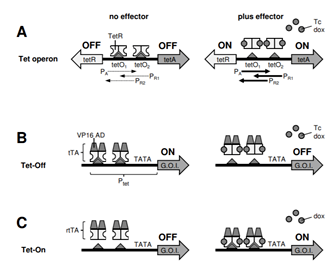
圖4 Tet抗性操縱子、Tet-Off和Tet-On系統原理[3]
四環素調控基因表達系統小鼠模型
四環素誘導系統主要通過pTRE和tTA/rtTA兩部分相互配合完成基因表達調控的功能。因此,利用四環素誘導系統在小鼠體內實現對目的基因表達的調控,原則上需要建立兩種小鼠。
首先,建立pTRE小鼠,需將目的基因插入到四環素依賴性啟動子下游,使目的基因的表達受四環素的控制。其次,需要建立tTA或者rtTA小鼠,該小鼠中的tTA/rtTA激活因子由特定啟動子驅動,可在特定細胞或者組織或者全身表達tTA或者rtTA。
這兩種小鼠繁育后,可獲得子代小鼠中既帶有pTRE及目的基因又帶有tTA/rtTA的小鼠,即可實現通過四環素的有無來調控基因的表達。
Tet-off小鼠模型
Tet-off小鼠模型是通過tTA小鼠同pTRE小鼠交配獲得。主要可應用于調控目的基因過表達的水平。例如,Giles等通過構建α-MHC-tTA; pTRE-cMyBP-C小鼠,進行了回復實驗(Rescueexperiments),即將α-MHC-tTA鼠、pTRE-cMyBP-C鼠同cMyBP-C 敲除鼠交配,利用四環素基因調控系統在cMyBP-C 敲除小鼠中恢復cMyBP-C的表達,進而驗證了cMyBP-C缺陷造成的心肌肥大的表型是可逆的。在這一系統中,通過注射四環素,還可以瞬時降低cMyBP-C的表達。可見,Tet-Off實現可以對基因的功能的全面的研究[5]。
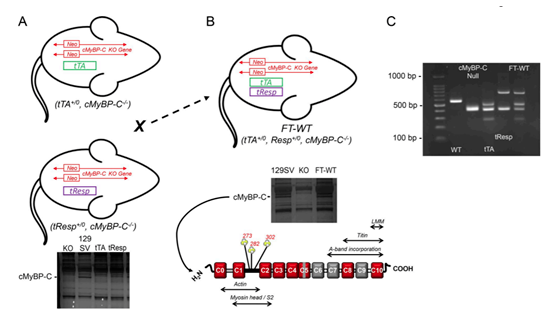
圖5 Tet-off小鼠模型
Tet-on小鼠模型
Tet-On小鼠模型是通過rtTA小鼠同pTRE小鼠交配獲得。主要應用于誘導目的基因過表達。例如,Song等通過構建Alb-rtTA小鼠,再注射pTRE-uPA腺病毒,制備肝臟損傷模型。Alb是肝臟特異表達的基因,uPA則是肝毒性物質,在注射四環素后,rtTA在Alb啟動子的作用下,將在肝臟中同pTRE結合,進而過表達下游基因uPA,造成肝臟損傷[6]。
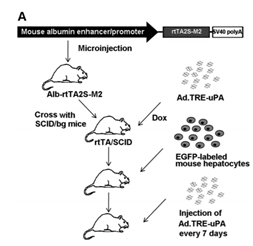
圖6 Tet-on小鼠模型
四環素調控系統的優勢
目前,除四環素誘導系統以外,科學家們還開發了多種條件性基因調控系統,如Cre-loxp系統、Flp-frt系統、Dre-rox系統等,而四環素誘導基因表達系統仍具有自己的獨特優勢。
首先Tet-On系統在沒有誘導時目的基因的表達水平比較低,誘導時表達水平增高,最高誘導倍數可達10000倍。
其次原核來源的TetR與TetO的結合特異性高,哺乳動物細胞中沒有類似的DNA靶向序列,所以Tet系統調控特異性高,并且宿主基因不受到影響,適合于體內外的各種基因表達的調控。
同時,Tet系統的誘導藥物為Tet或Dox,Tet作為一種抗生素已被人們應用了很長時間,是對人體較為安全的一種藥物,并且在Tet系統中低劑量的Tet就可調節基因的表達,所以不會對動物或細胞產生強毒性。
最后一點是,四環素系統具有可逆性,在去除誘導劑后可使系統關閉,也可反復加入誘導劑,多次啟動誘導反應。
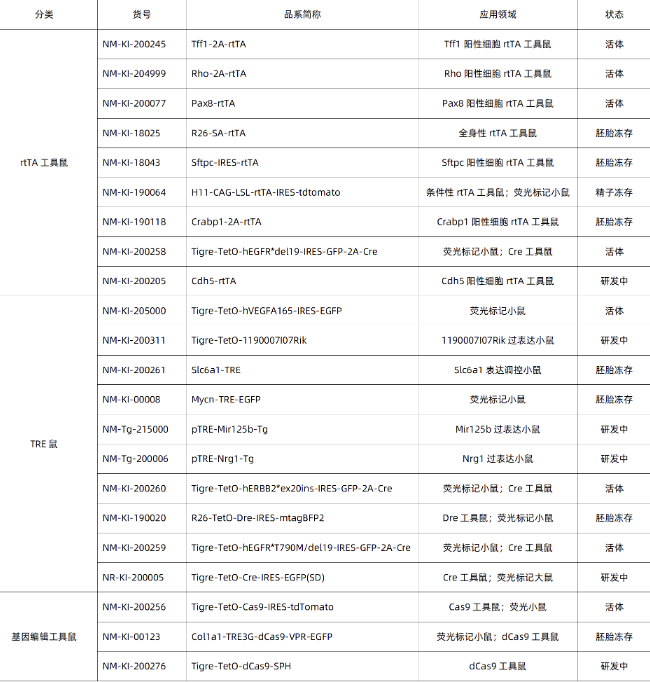
南模生物深耕基因編輯領域,在四環素誘導小鼠模型構建上有著成熟的技術和豐富的經驗,為您的基因功能研究之路保駕護航。已有和部分在研的四環素誘導動物模型信息見下表:
Reference:
[1]2013.igem.org/Team:Bielefeld-Germany/Biosafety/Biosafety_System_M
[2]www.addgene.org/collections/tetracycline
[3] Das AT, Tenenbaum L, Berkhout B. Tet-OnSystems For Doxycycline-inducible Gene Expression. Curr Gene Ther.2016;16(3):156-67.
[4] Loew R,Heinz N, Hampf M, Bujard H, Gossen M. Improved Tet-responsive promoters withminimized background expression. BMC Biotechnol. 2010 Nov 24;10:81.
[5] Giles J,Patel JR, Miller A, Iverson E, Fitzsimons D, Moss RL. Recovery of leftventricular function following in vivo reexpression of cardiac myosin bindingprotein C. J Gen Physiol. 2019 Jan 7;151(1):77-89.
[6] Song X, GuoY, Duo S, Che J, Wu C, Ochiya T, Ding M, Deng H. A mouse model of inducibleliver injury caused by tet-on regulated urokinase for studies of hepatocytetransplantation. Am J Pathol. 2009 Nov;175(5):1975-83.





 17312606166
17312606166