摘要:動物在很大程度上依賴其神經和免疫系統感知環境并在環境中生存。盡管傳統觀點認為大腦是免疫特權器官�,但神經和免疫系統相互作用會產生重大后果。環境中的微生物是刺激的主要來源���,可以與動物宿主建立從致病性到互惠性的關系�。各種人類和實驗動物系統的研究表明微生物群與神經和免疫系統之間的相互作用對正常發育、體內平衡和疾病有重要貢獻���。由于易于遺傳和微生物操作以及光學透明性便于體內成像,斑馬魚已經成為探索這些相互作用的優秀模型���。本文總結了利用斑馬魚分析免疫和神經系統、神經系統和微生物群以及微生物群和免疫系統之間的雙向控制的研究�。本文幫助我們理解這些系統在魚類感染過程中的相互聯系以及干擾如何導致病理�����。
背景:越來越多的人認識到脊椎動物中存在免疫系統�、神經系統和微生物群之間的深層相互聯系�,對每個系統的發育和穩態以及整個生物體的健康都很重要。例如���,在大腦中免疫系統和神經系統之間建立了正常的神經連接,在外圍儲備了免疫細胞���,而腸道神經系統在塑造腸道微生物生態方面起著重要作用,而腸道微生物生態反過來又會影響行為模式�。免疫系統本身對于控制微生物群組成非常重要而微生物群組成是腸道病原體易感性的主要決定因素�。這些系統相互作用以促進正常發育和體內平衡�����。當面臨感染或損傷等外部威脅時���,系統之間的協調對穩態恢復非常重要�。系統之間失調會導致病理�。斑馬魚作為一種模式生物,能夠深入了解免疫系統�、神經系統和微生物群之間的相互作用�。斑馬魚胚胎和仔魚的光學透明性加上轉基因魚系的發展壯大�����,感興趣的細胞被熒光標記,,有助于在發育過程中以及在感染或損傷時實時觀察完整活脊椎動物的免疫�����、神經和微生物群的相互作用�。斑馬魚的免疫系統與哺乳動物非常相似,包括適應性和先天免疫細胞(B 細胞、T 細胞�、巨噬細胞���、中性粒細胞等)和可溶性免疫介質���,如細胞因子和補體蛋白�����。斑馬魚和哺乳動物的大腦結構、細胞和遺傳程序之間也存在著強烈的同源性。斑馬魚是探索神經系統���、免疫系統和微生物群之間相互作用深度和復雜性的有力模型,這些相互作用對維持活脊椎動物的組織健康非常重要。我們回顧了斑馬魚免疫系統和神經系統、神經系統和微生物群之間以及發育過程中促進這些系統間穩態的微生物群和免疫系統雙向控制的現有文獻�����。我們探討了這些系統在魚類感染期間的相互聯系���,以及干擾如何導致病理�����。
免疫系統���、神經系統和微生物群之間的穩態控制:
神經系統的免疫控制:脊椎動物中,有明確的證據表明從細胞水平到行為水平的正常神經系統發育的免疫控制�。人們早就認識到在細胞水平上神經元凋亡是促進發育中大腦正常神經連接的關鍵機制�。這一過程早在斑馬魚受精后48小時(hpf)就發生�����。當觀察到死亡和死亡的神經元時�,小膠質細胞前體(注定要分化為中樞神經系統(CNS)中的常駐巨噬細胞)開始轉運到大腦以清除凋亡小體�����。雖然腦中凋亡小體的小膠質細胞清除是神經系統發育的穩態免疫控制的一個明顯例子�,但這種控制是雙向的�。最近的研究表明正是神經元凋亡本身部分通過核苷酸信號將小膠質細胞前體招募到腦中,導致整個大腦中小膠質細胞的正常擴張和分布�����。
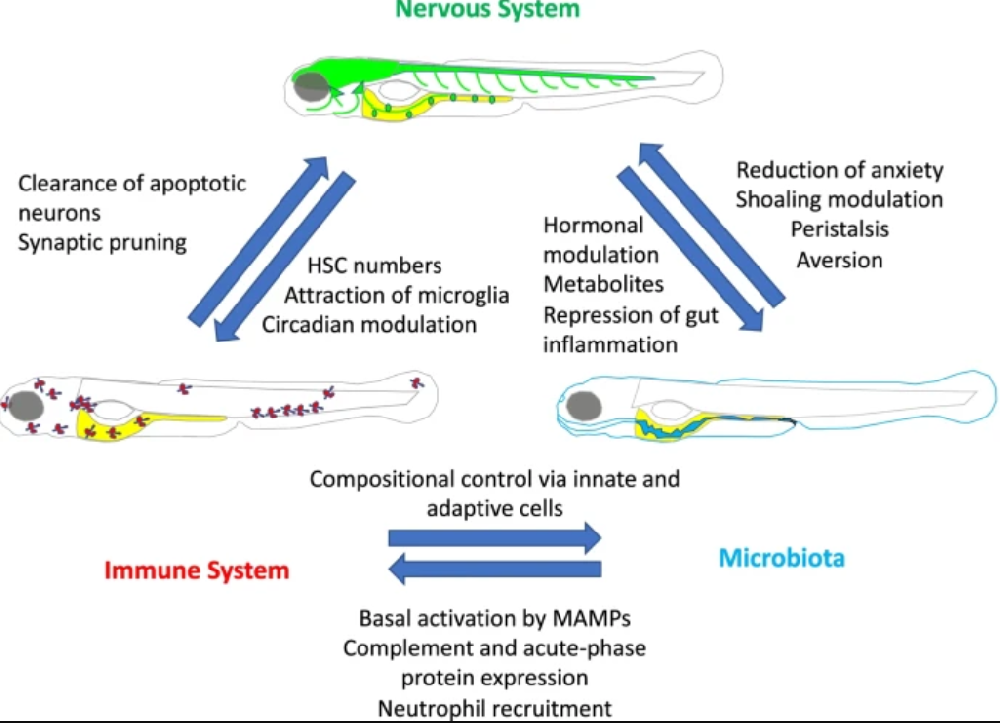
斑馬魚模型闡明神經系統、免疫系統和微生物群之間的穩態相互作用示例
有一些證據表明在行為水平上免疫控制社會行為���,缺乏淋巴細胞的小鼠有社會缺陷,并在額葉皮層大腦區域表現出超連接性�����。這些缺陷被證明是由于腦膜T細胞缺乏IFN-γ釋放所致�����,野生型動物的腦膜T淋巴細胞有助于大腦中的強直GABA能信號傳導���。雖然這項研究主要在小鼠中開展�����,但作者表明除了嚙齒動物�����,斑馬魚和果蠅在社會環境中上調 IFN-γ 和 JAK-STAT 誘導基因�。這項研究表明�,IFN-γ信號傳導和啟動強大病原體防御的能力在動物群體中是共同進化的,病原體傳播的可能性更大�����。雖然正常神經連接肯定存在免疫控制�����,但免疫系統在損傷后的組織再生中也起著關鍵作用���。與哺乳動物不同�,斑馬魚可以再生神經細胞�,因此是了解神經再生如何發生的有價值的模型。希望將這些知識轉化為未來的治療方法以治療創傷性腦和脊髓損傷以及神經退行性疾病�。成年斑馬魚腦損傷后���,白細胞募集到損傷部位�,在損傷部位表達促炎性細胞因子(TNFα�����、IL1β和IL-8)�,炎癥本身促進神經原細胞的增殖�。當成年魚形成適應性免疫時脊髓再生需要調節性T細胞(Treg)。Tregs 位于組織損傷部位���,例如受損的脊髓組織�,并釋放對受損器官特異的再生因子,它是再生因子而不是 Tregs 表達的抗炎細胞因子,促進神經祖細胞的增殖。在阿爾茨海默病模型神經再生免疫控制的例子中,小膠質細胞產生的IL-4足以通過IL-4R/STAT6途徑誘導成年斑馬魚大腦中因淀粉樣β42毒性而發生神經變性的區域的神經原細胞增殖�。
免疫系統的神經控制:
下丘腦-垂體-腎上腺軸對免疫細胞數量的控制:與上述發育中的大腦中小膠質細胞前體的凋亡神經元募集類似�����,免疫系統神經控制的另一個例子是中樞神經系統對周圍造血干細胞 (HSC) 數量的調節。已證明在斑馬魚胚胎發育過程中缺氧等壓力源可刺激 CNS 中血清素的產生。 5-羥色胺能刺激下丘腦-垂體-腎上腺/腎間 (HPA/I) 應激反應軸通過糖皮質激素受體增加外周 HSC 數量�,最終增加可用免疫細胞的數量�。同哺乳動物一樣�����,地塞米松治療斑馬魚仔魚出現消耗胸腺細胞的短期效果�。
晝夜節律和免疫:小鼠 HSC 的釋放也每天受到晝夜節律振蕩的調節�����,在光照和黑暗開始時每天兩個 HSC 峰值�。雖然尚不清楚晝夜節律是否調節斑馬魚 HSC 的釋放���,但晝夜節律確實對斑馬魚的免疫反應有很大影響�,可以被認為是免疫系統神經控制的另一個例子。哺乳動物下丘腦視交叉上核(SCN)和HPA軸之間的神經內分泌相互作用同步了外周組織免疫反應的晝夜節律控制。晝夜節律是內源性振蕩�,可將生物體的生理過程調整為?~?24小時明暗循環�����。這些振蕩對廣泛的行為活動和細胞和器官系統功能施加時間控制���,包括免疫功能���,例如先天免疫細胞從骨髓到血液和免疫器官的日常排出���、中性粒細胞運輸、定位和周轉、巨噬細胞吞噬活動 和細胞因子釋放。在細胞水平上,晝夜節律振蕩由一組保守的轉錄因子維持�,這些轉錄因子執行一個互鎖的���、有節奏的�����、自我延續的轉錄-翻譯反饋循環。 這些轉錄因子構成分子時鐘機制,在身體的所有主要器官和組織中表達���,并直接或間接地控制上述一系列過程。哺乳動物外圍時鐘通過位于下丘腦視交叉上核 (SCN) 中的主時鐘或中央時鐘與環境光暗循環同步�����。SCN 和 HPA 軸之間的神經內分泌相互作用最終使整個生物體組織中的外周時鐘同步�。 然而,這種層次結構并非對所有脊椎動物都通用, 斑馬魚沒有 SCN 結構���,這就引發了一個問題:魚是否需要“主時鐘”。最近的研究表明魚可以通過“多起搏器系統”使用多個時鐘中心來協調整個生物體的晝夜節律振蕩,類似于鳥類。這些時鐘中心中至少有一個位于松果體���,內在的晝夜節律振蕩直接被光通過具有視網膜視錐光感受器特征的細胞攜帶,然后驅動褪黑激素的產生。雖然與哺乳動物相比���,魚類的晝夜節律振蕩的協調更加分散�����,但這并不意味著神經內分泌相互作用對于調節魚類組織之間的這些振蕩以及對免疫反應的晝夜節律控制不重要���,相反是一個懸而未決的問題 。明暗循環確實對斑馬魚免疫有很大影響與哺乳動物類似���。雖然目前尚不清楚這種免疫反應的光依賴性調節是否依賴于分子鐘機制�,或者光調節的神經內分泌相互作用是否對魚類的免疫反應施加晝夜節律控制�����,但有一些證據表明���,晝夜節律的雙向免疫和神經系統控制���。
微生物群控制神經系統:根據“腸-腦軸”范式���,擾亂微生物群可能會導致行為改變甚至導致神經系統疾���。這一概念已廣受歡迎并引發了人們對飲食和/或益生菌可能有助于遏制神經退行性疾病發病率的上升的希望�����。斑馬魚至少在早期發育階段是測試這些問題的一個強大系統�,因為產生無菌仔魚很容易且成本低,可以以可控的方式繁殖���。用無菌的食物喂養這些無菌仔魚以便在幼年階段生長數周或在成年階段生長數月�����。大多數的斑馬魚行為分析都是在仔魚階段進行的���。仔魚的初始行為包括狩獵�、睡眠�����、學習���,可以通過高通量測定在受精后6天(dpf)開展���。在第二周發展社交互動(淺水行為)�。益生菌乳酸桿菌的施用會引起淺水行為的細微變化�,并且益生菌處理過的魚更喜歡呆在水體中的較高位置。這與微生物群組成的微小但顯著的變化有關,更引人注目的是與嚙齒動物腦內bdnf表達的增加有關�。BDNF(腦源性神經營養因子)是一種與各種情緒障礙有關的生長因子�。一項對無菌仔魚行為的早期研究發現與常規飼養或無菌常規化仔魚相比,6 dpf 時自發運動增加。細菌也可能對腸道神經系統產生影響���。 在單定殖或雙定殖斑馬魚模型中細菌病原體(霍亂弧菌)被證明不僅可以通過直接的細菌相互作用還可通過影響腸道蠕動來取代無害的共生物種。實時成像是研究斑馬魚宿主-病原體相互作用的主要工具,但它通常需要通過麻醉和嵌入低熔點瓊脂糖等凝膠來固定透明的仔魚�。常見的麻醉劑(例如三卡因甲磺酸鹽)通常不會阻止蠕動運動���,這使得腸道的實時成像極具挑戰性�����。 以前曾報道過僅限于短時間的斑馬魚腸腔中細菌的直接成像。每 20 分鐘對整個仔魚進行快速成像,持續時間超過 12 小時�����。受霍亂弧菌感染的魚類腸道收縮并不更頻繁但要強烈得多導致氣單胞菌排出�。這取決于弧菌的 VI 型分泌系統 (T6SS),弧菌直接殺死氣單胞菌也是如此。微生物群定植于腸道以外的其他粘膜。精細顯微解剖實驗顯示早在6dpf常規和GF仔魚的嗅覺上皮出現轉錄差異���。斑馬魚仔魚和成年小鼠無菌狀態導致許多嗅覺受體基因表達降低。這與嗅覺感覺上皮的細微形態學差異有關提示轉錄因子NRSF/REST在嗅覺器官微生物群依賴性基因抑制中起作用。
微生物群控制免疫系統:動物免疫系統已經進化到能夠感知各種微生物刺激并將這些信息傳遞給免疫系統的組成部分�����。由于共生微生物群在動物進化歷史中一直是刺激和潛在感染的源泉,作為其正常生命周期的一部分斑馬魚和其他動物的免疫系統確實會對微生物群作出反應。通過比較無菌飼養的斑馬魚和常規斑馬魚的微生物群�����,初步了解了斑馬魚對微生物群的免疫反應���。這項工作表明微生物群定植刺激補體和急性期蛋白的表達以及上皮屏障功能�����。無菌斑馬魚試驗分析表明微生物群刺激中性粒細胞標志物的表達�、中性粒細胞向腸道募集�、向外周傷口募集和其他全身性行為�。預計對其他免疫細胞系也有類似的影響但仍有待研究�。宿主對微生物群的免疫反應代表了對來自這些微生物群落的復雜刺激的聚合反應。無菌斑馬魚的研究表明宿主免疫反應能夠對微生物群的個體成員或其產物產生顯著的特異性。幾項研究強調了宿主如何將復雜的微生物群落輸入整合到適當的免疫反應中,這仍是一個重要的研究前沿。無菌斑馬魚定殖已知的共生細菌的混合物揭示特定菌株對中性粒細胞向腸道募集的影響不一定與該菌株在群落中的豐度成正比���。確定共生微生物群調節宿主先天免疫的特定機制是另一個重要的研究領域�。一個主要主題是微生物群影響宿主對炎癥刺激的敏感性的能力���。例如���,微生物群定植導致腸道上皮中腸道堿性磷酸酶的宿主表達增加���,這反過來又使腸道內的細菌脂多糖解毒�����,從而防止中性粒細胞過度募集到腸道。另一個新興主題是微生物群調節宿主組織特異性免疫調節細胞因子產生的能力�����。例如�,斑馬魚和哺乳動物的腸道和肝臟中的微生物群定殖時誘導急性期蛋白血清淀粉樣蛋白A(Saa)。斑馬魚的遺傳學研究表明其單一的Saa同源物可作為中性粒細胞的系統信號以限制激活�,降低炎癥張力和殺菌活性�,同時增強其遷移至周圍損傷部位的能力�。結果強調腸道微生物定植可以影響腸道和腸外免疫的不同方面。已知微生物群的存在和組成是斑馬魚和其他動物對腸道病原體易感性的主要決定因素���。
免疫系統控制微生物群:斑馬魚擁有 B 和 T 淋巴細胞的適應性免疫系統,攜帶涉及 RAG 蛋白的半隨機重組機制產生的抗原受體���。 事實上,rag1 缺陷斑馬魚缺乏 T 和 B 淋巴細胞已成為研究斑馬魚免疫系統的主要工具�。斑馬魚適應性免疫功能在微生物群最初定植腸道后幾周形成���。已經發現 在 1 周齡時無法區分rag1 缺陷型斑馬魚和野生型斑馬魚的微生物群組成�,但 5 周齡可明顯區分。與1周齡仔魚或rag1突變體相比�����,魚類和哺乳動物主要病原體弧菌的豐度受到rag1依賴機制的強烈控制,野生型成蟲的數量減少了4-5 log���。將lck:GFP?+?細胞(主要是 T 淋巴細胞)轉移到 rag1 缺陷的魚導致腸道中弧菌豐度的快速下降。表明這些魚類中存在大量腸道弧菌特異性T細胞�,�����,該細胞下調了潛在致病菌的數量�����。其他研究小組報告了成年野生型斑馬魚微生物群中的弧菌數量較多�,這突出了其他因素(如飲食和水特性)在最終微生物群組成中的貢獻。雖然飼養條件對最終微生物群組成有顯著影響�����,但rag1基因型沒有。與rag1突變體相比�����,野生型魚類的個體差異更大表明適應性免疫系統確實塑造了微生物群的組成���,但其可預測性較差�����。雖然在rag1突變體中研究了適應性免疫對微生物群組成的貢獻�,但先天免疫系統的影響尚未得到系統研究�。這主要是由于與適應性免疫的綜合特性相比,先天免疫系統具有非常模塊化的特性���,具有許多相對獨立的組成部分;不可能通過單一突變使整個先天免疫系統失活���。Myd88是TLR(toll樣受體)和IL-1家族受體信號轉導的主要適配器,MYD 88缺陷動物通常被視為先天免疫應答嚴重受損�����。Myd88突變斑馬魚確實存在嚴重的免疫缺陷�,在3周齡(即適應性免疫開始前不久)將其與野生型魚類進行了微生物群比較。在先天免疫細胞類型中�,已證明 irf8 突變斑馬魚中缺乏的腸道巨噬細胞的主要亞群對微生物群組成有影響�����。
神經系統控制微生物群:與免疫系統一樣,神經系統在感知外部環境和動物體內的特定刺激以及產生適當的直接和緊急反應方面發揮著主要作用。神經系統的基礎活動和誘發反應對每個器官系統以及行為等突發現象都有影響�����??梢灶A期神經系統功能的不同方面直接或間接影響微生物群的組成和活性。神經系統控制微生物群的最佳證據來自對調節腸道運動和蠕動的腸神經系統(ENS)的分析。發現由于 sox10 轉錄因子突變而缺乏 ENS 的斑馬魚仔魚腸道炎癥升高�。與sox10突變體中腸道微生物群組成的改變有關包括促炎弧菌的相對富集�����。與 WT 微生物群的 GF 受體相比,將 sox10 突變體的微生物群移植到 WT GF 受體導致腸道炎癥增加,表明 ENS 通常起到限制微生物群促炎潛力的作用�。使用一個GF 斑馬魚模型擴展了這一發現�����,其被促炎弧菌物種和/或共生氣單胞菌物種組成的微生物群落定殖。發現這與弧菌誘導腸道運動的能力有關,該能力選擇性地減少了氣單胞菌的數量���,而對弧菌沒有類似的影響。
腸道內的病原體感應:導致神經病理學的細菌感染:感染引發的神經-免疫相互作用導致病理的最著名的例子之一是麻風分枝桿菌感染后的周圍神經病變���。先前的體外研究表明,周圍神經損傷是麻風桿菌脫髓鞘和通過需要麻風桿菌外膜脂、酚糖脂 1 (PGL-1) 的相互作用感染雪旺氏細胞的直接結果�。最近使用斑馬魚胚胎作為麻風桿菌感染的模型宿主的研究改變了這一觀點���。利用斑馬魚胚胎的光學透明性�����,研究作者直接觀察了麻風桿菌感染后細菌�、神經膠質細胞�、神經細胞和免疫細胞的相互作用���,并表明���,雖然注入脊髓背側的細菌能夠改變軸突周圍神經膠質細胞的髓鞘結構�����,但未觀察到細菌本身直接感染神經膠質細胞�。所有細菌都局限于巨噬細胞�����,這些巨噬細胞本身直接與神經細胞軸突相互作用并巡邏。M. leprae PGL-1 刺激巨噬細胞產生活性氮物質�����,這與隨后有髓和無髓軸突的線粒體和軸突損傷有關�����。這項工作改變了對麻風桿菌感染后周圍神經病變的早期事件的理解���?����?紤]到麻風桿菌本身缺乏遺傳工具���,因為它是一種專性的細胞內病原體,并且缺乏可用于模擬麻風桿菌感染的遺傳易處理宿主�����,利用斑馬魚胚胎來模擬這些相互作用是一項重要進展�。雖然麻風桿菌感染與周圍神經系統損傷有關,但少數其他細菌能夠侵入中樞神經系統���,導致腦膜炎,包括無乳鏈球菌和肺炎鏈球菌等鏈球菌���。
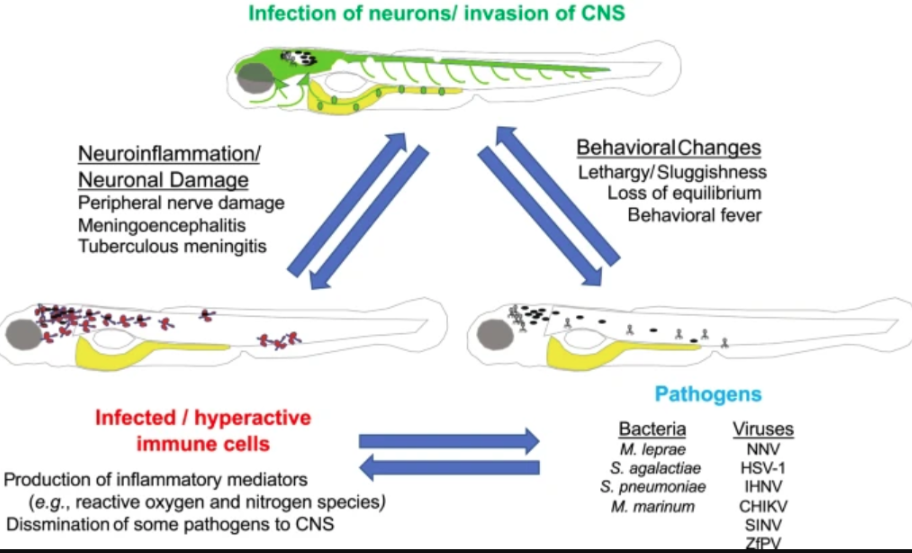
涉及CNS侵襲的病理相互作用示例
病毒感染導致病理:通過直接影響神經元或通過神經炎癥的間接影響,病原體感染中樞神經系統會導致行為改變���。我們將重點關注斑馬魚中樞神經系統的病毒感染及其影響。我們對斑馬魚病毒感染的大部分知識來源于實驗性感染系統�,感染系統中有來自其他魚類的病毒���,有時也有來自人類的病毒�,因為很長一段時間沒有發現天然斑馬魚病毒�����。ZfPV已在實驗室斑馬魚中檢測到�,并在世界各地的設施中廣泛存在���。尚未報告 CG2 斑馬魚中 zfPV 感染的病理或行為數據�����。NNV(神經壞死病毒)是多種熱帶和溫帶養殖海洋魚類中病毒性神經壞死或病毒性腦病和視網膜病的病原體�。已經建立了 NNV 感染的斑馬魚模型�,并且發現病毒嗜性(包括大腦中的最高數量)與在自然宿主中觀察到的相似。仔魚的死亡非???��,與較高的病毒滴度和較弱的I型干擾素應答有關。
結論:本文回顧的文獻強調了斑馬魚作為研究神經系統、免疫系統�、共生微生物和致病微生物之間復雜和相互作用的模型的廣泛用途�����。大多數這些見解都是由斑馬魚系統的提供的���。該領域的未來擴展將繼續需要更多的工具來成像和操縱特定的神經和免疫細胞類型和亞型以及它們的信號和其他活動�。在宿主和微生物以及斑馬魚系統中的化學和毒理學篩選中增加遺傳篩選的應用�,將在更廣泛領域增加這一非哺乳動物系統的價值。盡管這些斑馬魚研究提供了對神經-免疫-微生物相互作用的深入了解,但這些現有研究中的大多數都集中在成對的神經-免疫���、免疫-微生物�����、微生物-神經相互作用上�??紤]到所涉及的額外復雜性也許并不奇怪,相對較少的研究將所有三個組成部分一起考慮���。未來的研究需要同時考慮免疫和神經系統以及微生物相互作用�,以便更快地推進該領域�。此類研究將為已知涉及這三種成分的復雜疾病的機制提供強有力的見解。上述發現絕大多數處于相對早期的胚胎和仔魚階段�����。斑馬魚模型將繼續作為該領域未來研究中有價值的非哺乳動物模型系統�����。
原文出自:Using zebrafish to understand reciprocal interactions between the nervous and immune systems and the microbial world | SpringerLink





 17312606166
17312606166