1895年,瑞典化學(xué)家阿爾弗雷德·諾貝爾(Alfred Bernhard Nobel)創(chuàng)立諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)(Nobel Prize in Physiology or Medicine),旨在表彰在生理學(xué)或醫(yī)學(xué)領(lǐng)域作出重要發(fā)現(xiàn)或發(fā)明的人。該獎(jiǎng)項(xiàng)在1901年首次頒發(fā),1901至2021年,已累計(jì)頒發(fā)112次,共產(chǎn)生224位諾獎(jiǎng)得主。
一百余年來,諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)解答了有關(guān)生命和健康的諸多重要問題,是人類認(rèn)識(shí)自己和認(rèn)識(shí)世界的偉大探索。而在諾貝爾獎(jiǎng)成果的研究過程中,醫(yī)學(xué)實(shí)驗(yàn)動(dòng)物和相關(guān)動(dòng)物模型是不可或缺的極其重要的一環(huán)。中國實(shí)驗(yàn)動(dòng)物學(xué)會(huì)將通過一系列科普文章介紹諾貝爾獎(jiǎng)研究探索歷程中的動(dòng)物模型與實(shí)驗(yàn)醫(yī)學(xué)。
2021年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng):溫度與觸覺的動(dòng)物模型與實(shí)驗(yàn)醫(yī)學(xué)研究
溫度覺和觸覺是人們感知客觀世界的重要途徑,與視覺、嗅覺、味覺共同構(gòu)成了我們對(duì)客觀世界的認(rèn)識(shí)。
2021年10月4日,諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)揭曉,本次獎(jiǎng)項(xiàng)共同授予美國加州大學(xué)舊金山分校的戴維·朱利葉斯(David Julius)教授和美國加州斯克里普斯研究所、霍華德休斯醫(yī)學(xué)研究所的阿德姆·帕塔普蒂安(Ardem Patapoutian)教授,以表彰他們“發(fā)現(xiàn)了溫度和觸覺受體”。瑞典卡羅林斯卡學(xué)院的諾貝爾委員會(huì)表示,他們解開了大自然的奧秘,解析了感知熱、冷和機(jī)械力的分子機(jī)制。這是我們感知世界、與內(nèi)外環(huán)境互動(dòng)的基礎(chǔ),也是人類認(rèn)識(shí)環(huán)境、適應(yīng)環(huán)境的重要生理基礎(chǔ)。其實(shí)早在幾年前,這二位教授就曾“因?yàn)樗麄兏锩缘匕l(fā)現(xiàn)了溫度和壓力的受體”同時(shí)獲得過2019年第49屆羅森斯特爾獎(jiǎng)(Rosenstiel Award)、2020年卡弗里神經(jīng)科學(xué)獎(jiǎng)(Kavli Prize in neuroscience)和BBVA基金會(huì)“知識(shí)前沿獎(jiǎng)”(Frontiers of Knowledge Award)。

人類對(duì)溫度感知的探索由來已久。在東方傳統(tǒng)的中醫(yī)理論中,早在公元2世紀(jì)東漢張仲景在《傷寒雜病論》中系統(tǒng)性地將外感熱病的所有癥狀歸納為“六經(jīng)”(太陽、少陽、陽明、太陰、少陰、厥陰)和“八綱”(陰陽、表里、寒熱、虛實(shí)),并由此確立了有關(guān)寒、熱的中醫(yī)辨證論治的基本法則。相應(yīng)的,不同中藥藥材也具有溫、熱、寒、涼不同藥性,根據(jù)疾病的寒、熱選擇相應(yīng)的中醫(yī)治療。而對(duì)于非藥物治療,經(jīng)典針灸的“灸”法,同樣以“熱”為治療原理。在西方世界,17世紀(jì)法國著名哲學(xué)家笛卡爾在他的論著《論人》中提出,“熱”的信息可以傳遞至大腦產(chǎn)生反應(yīng)。直到幾個(gè)世紀(jì)以后的1944年,約瑟夫·厄爾蘭格(Joseph Erlanger)和赫伯特·斯潘塞·加塞(Herbert Spencer Gasser)“因?yàn)榘l(fā)現(xiàn)單神經(jīng)纖維高度分化的功能”共同獲得了諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng),他們把神經(jīng)纖維分為不同亞型,分別對(duì)神經(jīng)電信號(hào)具有不同的功能和傳導(dǎo)速度。也就是,神經(jīng)電信號(hào)的“高速路”已經(jīng)揭曉,但是仍有一個(gè)問題沒有解開:外界的冷熱、壓力等信息是如何轉(zhuǎn)化成神經(jīng)電信號(hào)呢?這也就是今年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)的答案。目前我們已經(jīng)知道,溫度感受器TRPV1、壓力感受器PIEZO1和PIEZO2等受體可以將溫度或壓力信息轉(zhuǎn)化為神經(jīng)信號(hào)并傳遞至神經(jīng)中樞,多年以來,科學(xué)家們是如何利用實(shí)驗(yàn)動(dòng)物研究解開有關(guān)溫度覺和觸覺的奧秘呢?
從辣椒到溫度感受器TRPV1
這個(gè)故事要從“辣椒”講起,我們都知道辣椒會(huì)給人“熱辣辣”的感覺,這種感覺如何產(chǎn)生?上世紀(jì)九十年代末,朱利葉斯和同事嘗試篩選感覺神經(jīng)元內(nèi)對(duì)辣椒素發(fā)生反應(yīng)的一系列基因DNA,試圖尋找辣椒素的“受體”,辣椒素和受體的關(guān)系就好像一把鑰匙打開一把鎖。
第一步:找到鑰匙和鎖。經(jīng)過建立一系列基因DNA庫并進(jìn)行篩選,他們最終鑒定出了一種非選擇性的陽離子通道TRPV1,同時(shí)發(fā)現(xiàn)它也對(duì)傷害性高溫(>43℃)有反應(yīng)——這把“鎖”,既可以被辣椒素打開,也可以被高溫打開,辣椒熱辣辣的感覺也就由此而來。
第二步:利用動(dòng)物模型認(rèn)識(shí)“鎖”的分布。在實(shí)驗(yàn)大鼠上,他們發(fā)現(xiàn)諸多感覺神經(jīng)節(jié)細(xì)胞內(nèi)都可以找到這種“鎖”,即存在TRPV1的表達(dá),它可以表達(dá)在背根神經(jīng)節(jié)和三叉神經(jīng)節(jié)(主要集中在小直徑的神經(jīng)元胞體,在大直徑的神經(jīng)元胞體上較少)、脊髓和腦內(nèi)尾狀核等區(qū)域。實(shí)驗(yàn)大鼠幫助人們初步獲得了有關(guān)TRPV1分布的認(rèn)識(shí)。
第三步:建立轉(zhuǎn)基因動(dòng)物模型研究其功能。隨后,研究人員創(chuàng)制了敲除TRPV1基因的轉(zhuǎn)基因小鼠模型,發(fā)現(xiàn)這種小鼠對(duì)高溫的熱痛反應(yīng)幾乎消失,而機(jī)械力的痛覺反應(yīng)正常,也就提示TRPV1對(duì)于溫度(高溫)傳導(dǎo)具有不可或缺的作用。近年來對(duì)TRPV1的研究仍然集中在他的溫度傳導(dǎo)機(jī)制,特別是傷害性高溫傳導(dǎo)。在炎癥性疼痛過程中,機(jī)體的“紅、腫、熱、痛”也離不開TRPV1的參與。
從薄荷到冷覺感受器TRPM8
和辣椒相對(duì)應(yīng),薄荷給人帶來的冰涼感覺從何而來?帕塔普蒂安和同事在2002年鑒定出了傳導(dǎo)冷覺的受體TRPM8,它是TRPV1的親戚,同屬于TRP受體家族。類似的,他們發(fā)現(xiàn)TRPM8可以同時(shí)對(duì)低溫和薄荷產(chǎn)生反應(yīng),這些“鎖”也主要分布在傳導(dǎo)感覺的背根神經(jīng)節(jié)。近年來,利用基因編輯技術(shù)、在體鈣成像等新技術(shù),研究人員利用嚙齒類動(dòng)物模型、基因的時(shí)間、空間選擇性表達(dá)模型,對(duì)TRP家族的溫度感受機(jī)制進(jìn)行了深入探索,不同的溫度范圍可以打開相應(yīng)的“鎖”。外周的冷、熱刺激通過激活這一家族里相應(yīng)的溫度覺受體,通過相應(yīng)的TRPV1陽性或TRPM8陽性的背根神經(jīng)節(jié)傳導(dǎo)感覺信息,在脊髓產(chǎn)生明顯的鈣激活過程,系統(tǒng)完善了溫度的感覺傳導(dǎo)機(jī)制。
從細(xì)胞戳戳樂到壓力感受器PIEZO1和PIEZO2
與溫度感受的機(jī)制類似,機(jī)械力刺激如何轉(zhuǎn)化為神經(jīng)電信號(hào)?帕塔普蒂安和同事選擇了一種對(duì)機(jī)械力有反應(yīng)的細(xì)胞Neuro2A,一邊戳戳細(xì)胞,一邊從細(xì)胞中篩選出對(duì)壓力有反應(yīng)的候選基因,最終一個(gè)機(jī)械敏感的離子通道脫穎而出,他們用希臘語的壓力“piesi”一詞命名它為PIEZO1。后續(xù)又鑒定出了PIEZO2,并發(fā)現(xiàn)它在背根神經(jīng)節(jié)感覺神經(jīng)元內(nèi)有大量表達(dá)。研究發(fā)現(xiàn)PIEZO1和PIEZO2均可以被細(xì)胞膜表面的機(jī)械力直接激活產(chǎn)生反應(yīng)。2014年,帕塔普蒂安和同事共同創(chuàng)制了在DRG感覺神經(jīng)元內(nèi)敲除PIEZO2的轉(zhuǎn)基因小鼠模型PIEZO2CKO小鼠。在沒有PIEZO2的情況下,小鼠的觸覺反應(yīng)消失,進(jìn)一步驗(yàn)證了它在觸覺感受中的重要功能。隨著研究的逐步深入,PIEZO的功能也逐步擴(kuò)展到更多的壓力感受相關(guān)功能,如觸覺、疼痛、血壓、呼吸和膀胱功能等。
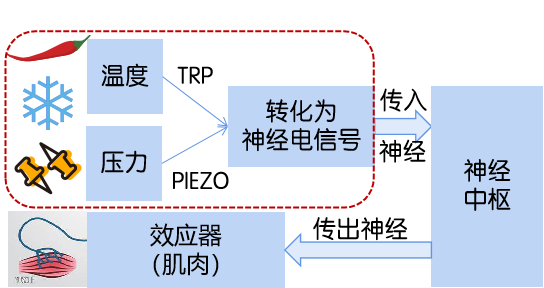
溫度、壓力等外界信息通過TRP或PIEZO等受體轉(zhuǎn)化為神經(jīng)電信號(hào),通過傳入神經(jīng)抵達(dá)神經(jīng)中樞并沿產(chǎn)出神經(jīng)調(diào)節(jié)效應(yīng)器,形成反射弧,對(duì)外環(huán)境產(chǎn)生反應(yīng)和適應(yīng)。紅色虛線內(nèi)為2021年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)的相關(guān)內(nèi)容。
回顧多年來人類對(duì)溫度覺和觸覺的研究過程,通過細(xì)胞、動(dòng)物模型、人類疾病等多層次的實(shí)驗(yàn)醫(yī)學(xué)研究,外界溫度和壓力的“鑰匙”如何打開對(duì)應(yīng)“鎖”的問題已經(jīng)逐步解開。隨著基因編輯技術(shù)和實(shí)驗(yàn)檢測方法的發(fā)展,不斷涌現(xiàn)出更好的實(shí)驗(yàn)動(dòng)物研究模型,對(duì)TRP家族和PIEZO的更多功能的認(rèn)識(shí)也在日漸加深。外界信息由此轉(zhuǎn)化為神經(jīng)電信號(hào)、形成神經(jīng)反射,實(shí)現(xiàn)了生物體對(duì)外界環(huán)境的反應(yīng)和適應(yīng)。多年來研究人員利用實(shí)驗(yàn)動(dòng)物模型進(jìn)行的研究幫助我們更好的認(rèn)識(shí)世界,也認(rèn)識(shí)了自己。
(張鈺 供稿)
參考文獻(xiàn)
1. The Nobel Prize in Physiology or Medicine 2021. NobelPrize.org. Nobel Prize Outreach AB 2021. Sun. 31 Oct 2021.
2. Prize announcement. NobelPrize.org. Nobel Prize Outreach AB 2021. Sun. 31 Oct 2021.
3. Xie D, Liu Z, Hou X, Zhang B, Xiong J, Yi M, Chen R. Heat sensitisation in suspended moxibustion: features and clinical relevance. Acupunct Med. 2013 Dec;31(4):422-4.
4. Liao F, Zhang C, Bian Z, Xie D, Kang M, Li X, Wan Y, Chen R, Yi M. Characterizing heat-sensitization responses in suspended moxibustion with high-density EEG. Pain Med. 2014 Aug;15(8):1272-81.
5. The Nobel Prize in Physiology or Medicine 1944. NobelPrize.org. Nobel Prize Outreach AB 2021. Thu. 11 Nov 2021.
6. Joseph Erlanger – Facts. NobelPrize.org. Nobel Prize Outreach AB 2021. Thu. 11 Nov 2021.
7. Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 1997 Oct 23;389(6653):816-24.
8. Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D. The cloned capsaicin receptor integrates multiple pain-producing stimuli. Neuron. 1998 Sep;21(3):531-43.
9. Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science. 2000 Apr 14;288(5464):306-13.
10. Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, Earley TJ, Dragoni I, McIntyre P, Bevan S, Patapoutian A. A TRP channel that senses cold stimuli and menthol. Cell. 2002 Mar 8;108(5):705-15.
11. McKemy DD, Neuhausser WM, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature. 2002 Mar 7;416(6876):52-8.
12. Clapham DE. TRP channels as cellular sensors. Nature. 2003 Dec 4;426(6966):517-24.
13. Luo H, Cheng J, Han JS, Wan Y. Change of vanilloid receptor 1 expression in dorsal root ganglion and spinal dorsal horn during inflammatory nociception induced by complete Freund's adjuvant in rats. Neuroreport. 2004 Mar 22;15(4):655-8.
14. Han Y, Li Y, Xiao X, Liu J, Meng XL, Liu FY, Xing GG, Wan Y. Formaldehyde up-regulates TRPV1 through MAPK and PI3K signaling pathways in a rat model of bone cancer pain. Neurosci Bull. 2012 Apr;28(2):165-72.
15. Li Y, Cai J, Han Y, Xiao X, Meng XL, Su L, Liu FY, Xing GG, Wan Y. Enhanced function of TRPV1 via up-regulation by insulin-like growth factor-1 in a rat model of bone cancer pain. Eur J Pain. 2014 Jul;18(6):774-84.
16. Yang F, Guo J, Sun WL, Liu FY, Cai J, Xing GG, Wan Y. The induction of long-term potentiation in spinal dorsal horn after peripheral nociceptive stimulation and contribution of spinal TRPV1 in rats. Neuroscience. 2014 Jun 6;269:59-66.
17. Wan Y. New Mechanism of Bone Cancer Pain: Tumor Tissue-Derived Endogenous Formaldehyde Induced Bone Cancer Pain via TRPV1 Activation. Adv Exp Med Biol. 2016;904:41-58.
18. Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE, Patapoutian A. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science. 2010 Oct 1;330(6000):55-60.
19. Ranade SS, Woo SH, Dubin AE, Moshourab RA, Wetzel C, Petrus M, Mathur J, Bégay V, Coste B, Mainquist J, Wilson AJ, Francisco AG, Reddy K, Qiu Z, Wood JN, Lewin GR, Patapoutian A. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature. 2014 Dec 4;516(7529):121-5.
20. Woo SH, Lukacs V, de Nooij JC, Zaytseva D, Criddle CR, Francisco A, Jessell TM, Wilkinson KA, Patapoutian A. Piezo2 is the principal mechanotransduction channel for proprioception. Nat Neurosci. 2015 Dec;18(12):1756-62.





 17312606166
17312606166 加微信獲取對(duì)接
加微信獲取對(duì)接