器官移植已成為多種終末期疾病的唯一有效治療手段,供體器官嚴重缺乏卻限制了這一療法在臨床上廣泛應用。基于干細胞的器官異種動物體內再生將是未來解決這一問題的理想途徑。通過該途徑獲得的人源化器官不僅將具有更全面的細胞類型和更完善的器官結構與功能,而且由于供體細胞來源于患者自體,將有效避免異種器官或同種異體器官移植中存在的免疫排斥等問題。
中國科學院廣州生物醫藥與健康研究院在《細胞-干細胞》(Cell Stem Cell)上,發表了封面研究論文,報道了利用胚胎補償技術在豬體內成功再造人源中腎的策略。
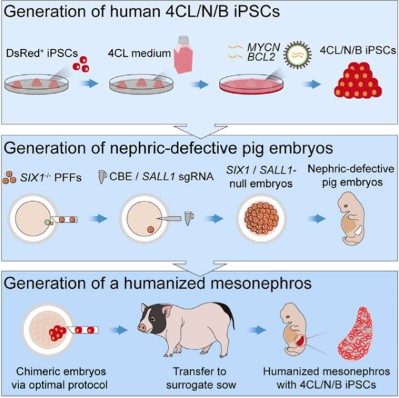
該研究利用具有高分化潛能、強競爭及抗凋亡能力的新型人誘導多能干細胞,結合優化的胚胎補償技術體系,在腎臟缺陷豬模型體內實現了人源化中腎的異種體內再生,這是迄今世界范圍內首次報道的人源化器官異種體內再生案例。
基于胚胎補償技術實現人源化器官異種體內再生存在諸多障礙,包括人源多能干細胞的分化能力不足,在異種動物胚胎內的生存能力低下、大動物模型提供的器官缺陷生態位難以形成、異種胚胎嵌合補償技術體系不完善等,導致從豬體內培育人體器官的設想一直沒有成功。
為了尋求突破點,中國科學院廣州生物醫藥與健康研究院賴良學課題組、潘光錦課題組以及Miguel A. Esteban課題組組成聯合攻關團隊,圍繞人體腎臟的異種再生這一世界難題開展了5年多的研究。
攻關團隊對人-豬胚胎補償技術體系進行了全方位的優化,確定了理想的胚胎補償技術流程,即在桑葚到早期囊胚時期注射3-5個人源供體細胞,以構建嵌合胚胎,后者在等比例混合的胚胎培養基和干細胞培養基中培養24小時后,移植入發情周期同步的代孕豬,即可獲得嵌合豬胎兒,成功實現了人源化中腎的異種體內再生。
該研究嚴格遵守相關倫理規定以及國際慣例,在3-4周胎齡內終止了妊娠。研究共獲得2只胎齡25天,3只胎齡28天的中腎嵌合胎兒。這些嵌合胎兒的中腎內人源細胞占比最高可達70%,而人源細胞參與形成的中腎小管所占比例最高可達58%。針對腎臟發育關鍵功能性基因SIX1、SALL1、PAX2及WT1的免疫熒光染色結果證明,人源供體細胞已分化成為表達這些基因的功能性細胞,說明伴隨著胚胎發育,腎臟缺陷豬胎兒體內的人源供體細胞將能夠支持人源化腎臟生成。
這一成果首次證明了基于干細胞及胚胎補償技術在異種大動物體內再造人源化實質器官的可行性,為利用器官缺陷大動物模型進行器官異種體內再生邁出了關鍵一步,對解決供體器官嚴重短缺難題具有重要意義。
研究工作得到中國科學院戰略性先導科技專項“器官重建與制造”和國家重點研發計劃等的支持。
研究示意圖





 17312606166
17312606166