臨床和實驗證據均表明外周神經損傷后機體常表現為痛覺過敏和記憶障礙共病,然而共病機制并不清楚。研究證明星形膠質細胞釋放的乳酸不僅是神經元優先利用的能量底物,而且作為信號分子在神經元興奮性調控及突觸可塑性調節中發揮著重要作用。
中山大學中山醫學院魏緒紅副教授、蔣斌教授團隊合作在麻醉學頂級期刊Anesthesiology發表了題為“Impaired lactate release in dCA1 astrocytes contributed to nociceptive sensitization and comorbid memory deficits in rodents”的論文,探究了背側海馬CA1區星形膠質細胞乳酸釋放減少在痛覺過敏和記憶障礙共病中的作用。
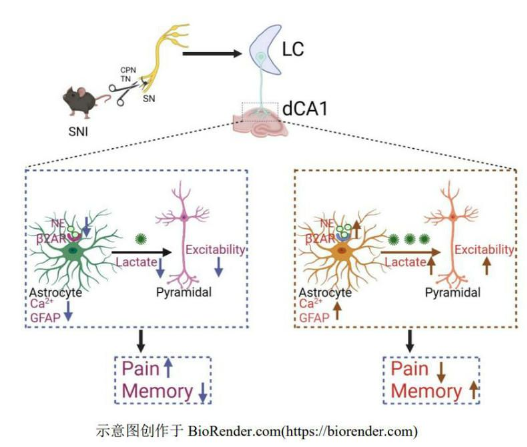
此研究利用坐骨神經分支選擇性損傷模型(SNI)小鼠,發現10天后即出現共病,同時, 背側海馬CA1星形膠質細胞鈣信號對機械痛刺激的反應明顯減弱、星形膠質細胞GFAP表達量以及分支明顯減少,乳酸含量明顯降低,離體全細胞膜片鉗發現錐體神經元內在興奮性明顯下降。而在 SNI 鼠 CA1區外源性補充乳酸能夠提高機械痛閾、引起條件位置性偏愛、提高新奇事物認知能力并提高錐體神經元的興奮性。
相反,在正常動物用糖原磷酸化酶抑制劑抑制 CA1 乳酸合成或通過抑制單羧酸轉運體阻斷乳酸轉運到錐體神經元,均引起正常動物痛覺過敏和記憶障礙。化學遺傳學特異性激活藍斑(LC)到背側海馬CA1 去甲腎上腺素能投射能緩解共病。同時,化學遺傳學激活 LC 去甲腎上腺素能神經元可以提高共病鼠dCA1 星形膠質細胞鈣信號,并增加乳酸釋放。這一研究發現了外周神經損傷小鼠CA1星形膠質細胞異常導致乳酸釋放減少,進而引起錐體神經元興奮性下降,最終使小鼠出現共病,而激活LC去甲腎上腺素能神經元則能夠緩解上述表現。證實了外周神經損傷后LC去甲腎上腺素能神經元未能充分驅動dCA1星形膠質細胞的乳酸釋放功能來支持錐體神經元的興奮性,導致共病。這為治療神經病理性疼痛和記憶障礙共病提供了潛在靶點,以及提供了新的研究通路方向。
中山醫學院魏緒紅副教授為該論文的獨立通訊作者,研究生韓霜、蔣斌教授和研究生任佳樂為該論文的共同第一作者。研究工作得到了中山大學疼痛研究中心劉先國教授的大力幫助。該研究受國家自然科學基金、廣東省自然科學基金等項目資助。





 17312606166
17312606166