近日�����,上海交通大學章雪晴教授��、新澤西理工學院許曉陽教授團隊合作�����,在 Nature Communications 期刊發(fā)表了題為:mRNA lipid nanoparticle-mediated pyroptosis sensitizes immunologically cold tumors to checkpoint immunotherapy 的研究論文。
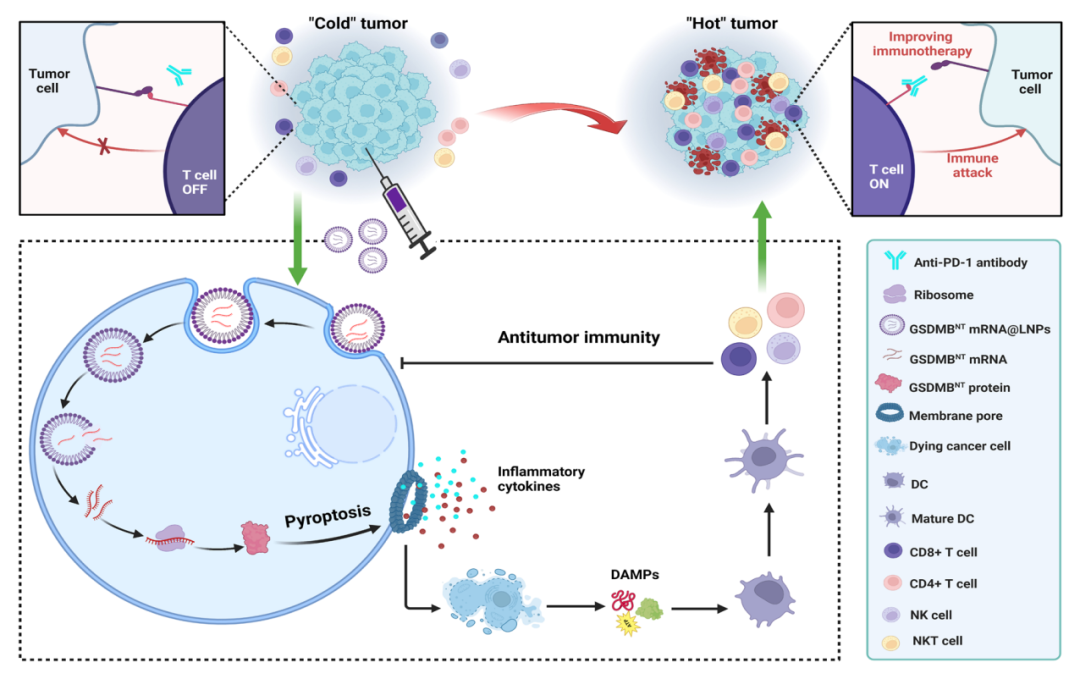
該研究提出了一種基于mRNA的細胞焦亡納米藥物治療方法,它能夠啟動癌癥免疫周期�����,將冷腫瘤轉(zhuǎn)化為炎癥細胞因子表達和T細胞浸潤的熱腫瘤�����,從而有效治療免疫冷腫瘤����。

細胞焦亡(pyroptosis)是一種炎癥性程序性細胞死亡��,由gasdermin(GSDM)家族蛋白的蛋白水解性裂解觸發(fā)����。GSDM通常通過其N端和C端結(jié)構(gòu)域的分子內(nèi)相互作用而自我抑制��。在連接區(qū)被特異性半胱氨酸天冬氨酸蛋白酶和其他蛋白酶裂解后�����,壞死性端結(jié)構(gòu)域形成低聚物并轉(zhuǎn)移到質(zhì)膜��。游離N端結(jié)構(gòu)域與脂質(zhì)成分結(jié)合并在細胞膜上并打孔�����,導(dǎo)致質(zhì)膜快速破裂,并釋放危險相關(guān)分子模式(DAMP)和促炎細胞因子。免疫細胞識別特定的DAMP,進而觸發(fā)一系列免疫反應(yīng)��,包括免疫細胞的激活和浸潤��。此外��,通過焦亡孔釋放的促炎細胞因子有助于逆轉(zhuǎn)免疫抑制性腫瘤微環(huán)境(TME)。
盡管這些發(fā)現(xiàn)令人鼓舞�����,但許多癌癥中GSDM的低表達和復(fù)雜的裂解過程阻礙了通過遞送蛋白酶來觸發(fā)細胞焦亡以產(chǎn)生抗腫瘤免疫��。
研究團隊推測通過直接傳遞N末端GSDM結(jié)構(gòu)域誘導(dǎo)的細胞焦亡是在癌癥免疫周期中引發(fā)一系列事件并將冷腫瘤轉(zhuǎn)化為熱腫瘤的有效方法����。
基于mRNA納米藥物的基因治療具有廣闊的臨床應(yīng)用前景��。最近�����,該成功開發(fā)了一種可合成的可電離陽離子脂質(zhì)納米顆粒(AA3-Dlin LNPs)的制劑,該制劑具有良好的安全性和較高的體內(nèi)外mRNA翻譯效率。mRNA-LNPs與GSDM協(xié)同激活細胞焦亡,有望在腫瘤治療中發(fā)揮重要作用。
在該研究中��,我們提出了一種基于mRNA的納米醫(yī)學方法,其中AA3-Dlin LNP配方封裝了一個編碼GSDMB N-端結(jié)構(gòu)域的單劑mRNA——GSMDBNT mRNA@LNP��。開發(fā)的GSMDBNT mRNA@LNP配方由可電離陽離子脂質(zhì)(AA3-Dlin)��、磷脂����、膽固醇和PEG自組裝�����,GSMDBNT mRNA通過靜電相互作用被包裹在LNP內(nèi)����。
研究團隊期望這種LNP可以被遞送到腫瘤組織中����,在那里,mRNA被翻譯為GSDMB蛋白的端結(jié)構(gòu)域�����,并直接觸發(fā)細胞焦亡�����,而不需要蛋白酶裂解�����。
細胞焦亡具有誘導(dǎo)免疫細胞死亡、啟動促炎細胞因子釋放以及激活和招募腫瘤內(nèi)免疫細胞的能力����,進而導(dǎo)致一系列事件,進一步促進細胞死亡��、細胞因子釋放和免疫應(yīng)答激活�����。由此產(chǎn)生的正反饋回路可創(chuàng)建有利的免疫原性熱腫瘤微環(huán)境�����,使癌細胞對免疫檢查點阻斷(ICB)介導(dǎo)的免疫治療敏感�����,顯示出優(yōu)于單藥治療的腫瘤抑制作用�����。
體外細胞實驗結(jié)果表明,即使由單藥GSMDBNT mRNA@LNP觸發(fā)的低水平腫瘤細胞焦亡也足以誘導(dǎo)穩(wěn)定的免疫原性細胞死亡����。
在多個免疫冷腫瘤小鼠模型中����,研究結(jié)果表明,mRNA-LNP觸發(fā)的細胞焦亡可以抑制腫瘤生長和延長小鼠模型總生存期����,并伴有促炎細胞因子的刺激和促進腫瘤微環(huán)境中免疫細胞的募集�����。
此外��,mRNA-LNP觸發(fā)細胞焦亡還可以提高免疫檢查點抑制劑(aPD-1)介導(dǎo)的免疫治療的療效����,甚至在原位4T1乳腺癌和高度侵襲性B16F10黑色素瘤模型中實現(xiàn)腫瘤消除和長期生存�����。
此外��,該研究還發(fā)現(xiàn),mRNA-LNP觸發(fā)細胞焦亡可以與aPD--1介導(dǎo)的免疫治療有效協(xié)同治療效果�����,誘導(dǎo)局部免疫應(yīng)答��,進而產(chǎn)生全身效應(yīng)����,根除黑色素瘤和抑制遠端腫瘤的生長。
綜上所述,該研究表明,基于mRNA的細胞焦亡納米藥物提供了一種簡單而高效的策略����,以實現(xiàn)強大的抗腫瘤免疫和增強免疫冷腫瘤的免疫治療效果�����。更重要的是,該研究提供了一個通用平臺,有望擴展到免疫檢查點阻斷療法之外的其他免疫治療方法��,具有很高的轉(zhuǎn)化應(yīng)用前景����。





 17312606166
17312606166