糖尿病作為一種慢性代謝性疾病,通常不會(huì)在患者身上獨(dú)立存在,而常與其他諸多非健康狀態(tài)或疾病并存,在這個(gè)數(shù)病齊發(fā)的過程中糖尿病往往是“開路先鋒”,據(jù)統(tǒng)計(jì)全球高達(dá)4億多人飽受糖尿病困擾,其中我國(guó)糖尿病患病人數(shù)居全球之首,已超1.3 億。為了解決糖尿病這個(gè)“甜蜜負(fù)擔(dān)”,我們需要探究糖尿病的發(fā)病機(jī)制,針對(duì)每一類糖尿病構(gòu)建合適的動(dòng)物模型,開發(fā)對(duì)癥的藥物。今天,小編就為大家介紹一下糖尿病研究常用的模型。
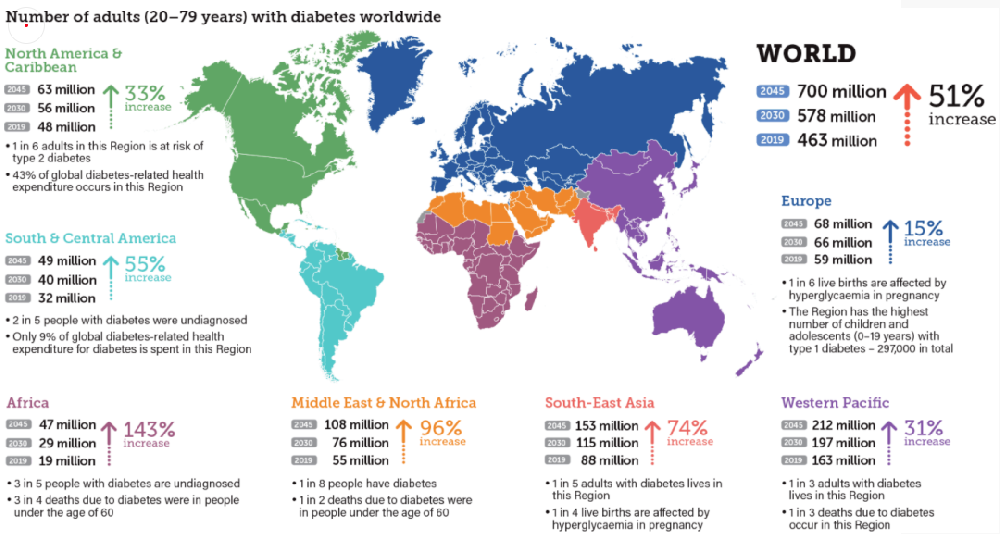
圖1.全球糖尿病患者統(tǒng)計(jì)
糖尿病是以高血糖為特征的慢性代謝性疾病,且難以治愈一般需要終生服藥。糖尿病的可怕在于其會(huì)導(dǎo)致眼、腎、心臟、血管、神經(jīng)等組織器官的慢性損傷和功能障礙,并有概率引起各種并發(fā)癥,如失明、腎衰竭、心臟病、中風(fēng)和下肢截癱等。據(jù)《中國(guó)2型糖尿病防治指南(2020版)》指出,我國(guó)糖尿病患病率已上升至11.2%,也就是說我國(guó)每10個(gè)成年人就有1個(gè)糖尿病患者,這對(duì)個(gè)人和社會(huì)都是沉重的負(fù)擔(dān)[1]。
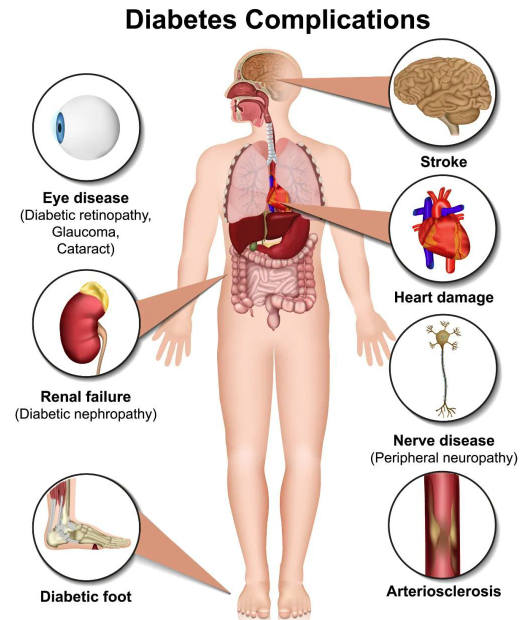
圖2.糖尿病并發(fā)癥
臨床上對(duì)于糖尿病的病因分型,目前應(yīng)用最為廣泛、大體上最被公認(rèn)是1999年世界衛(wèi)生組織(WHO)公布的這4類,即1型糖尿病(T1DM)、2型糖尿病(T2DM)、特殊類型糖尿病和妊娠期糖尿病(GDM)。2019年WHO又在此基礎(chǔ)上,將成人隱匿性自身免疫糖尿病(LADA)和酮癥傾向T2DM歸類為“混合型糖尿病”,且添加了“未分類糖尿病”,從而將糖尿病分為6種類型[5]。每種類型糖尿病的特征如下:
T2DM是糖尿病患者中最主要的群體,其主要發(fā)病原因是胰島素抵抗及胰島素分泌相對(duì)不足。
T1DM是由于胰島β細(xì)胞破壞、胰島素分泌缺乏所致,特征是胰島功能差,終身需要依賴胰島素治療。
繼發(fā)性糖尿病是一類由特定疾病或藥物等相關(guān)因素引起血糖升高的糖尿病類型。
GDM是指與妊娠狀態(tài)相關(guān)的糖代謝異常,但未達(dá)到非孕人群糖尿病診斷標(biāo)準(zhǔn),GDM患者糖代謝多數(shù)于產(chǎn)后能恢復(fù)正常,但將來患II型糖尿病概率也會(huì)增加。
單基因糖尿病由影響胰島β細(xì)胞發(fā)育、功能或胰島素作用的單個(gè)基因突變所致,約占所有糖尿病的1%~5%,迄今已發(fā)現(xiàn)70余個(gè)單基因糖尿病的致病基因,大多數(shù)通過影響胰島β細(xì)胞功能而致血糖異常。
未定型糖尿病指部分糖尿病患者表現(xiàn)不典型,根據(jù)其癥狀、體征和已經(jīng)完成前述的胰島功能、胰島自身抗體及基因檢測(cè)等結(jié)果仍不能分型者。
目前,市面上已有多款治療不同糖尿病的藥物,這些藥物有效改善了眾多糖尿病患者的生活質(zhì)量,但現(xiàn)有的治療策略無法阻止糖尿病的進(jìn)展和慢性并發(fā)癥的發(fā)生,且大部分藥物針對(duì)的都是最常見的T2DM和T1DM,其他類型的糖尿病人缺乏足夠的治療手段。因此,糖尿病的研究依然任重道遠(yuǎn)。
糖尿病實(shí)驗(yàn)動(dòng)物模型作為重要的科研工具,在糖尿病機(jī)理研究,藥物篩選以及藥物臨床前實(shí)驗(yàn)都發(fā)揮了重要作用。目前,隨著生物醫(yī)學(xué)技術(shù)的不斷進(jìn)步,糖尿病動(dòng)物模型造模所用的實(shí)驗(yàn)動(dòng)物種類和造模手段日呈多元化發(fā)展,糖尿病動(dòng)物模型的構(gòu)建也能更好地模擬人類糖尿病的發(fā)生發(fā)展。針對(duì)不同因素導(dǎo)致的糖尿病,研究人員應(yīng)選擇與之研究主體相接近的糖尿病模型作為研究對(duì)象。小編在此歸納總結(jié)了當(dāng)前糖尿病研究的主要嚙齒類模型,以饗讀者。

圖3.小鼠模型
2.1 自發(fā)性糖尿病模型
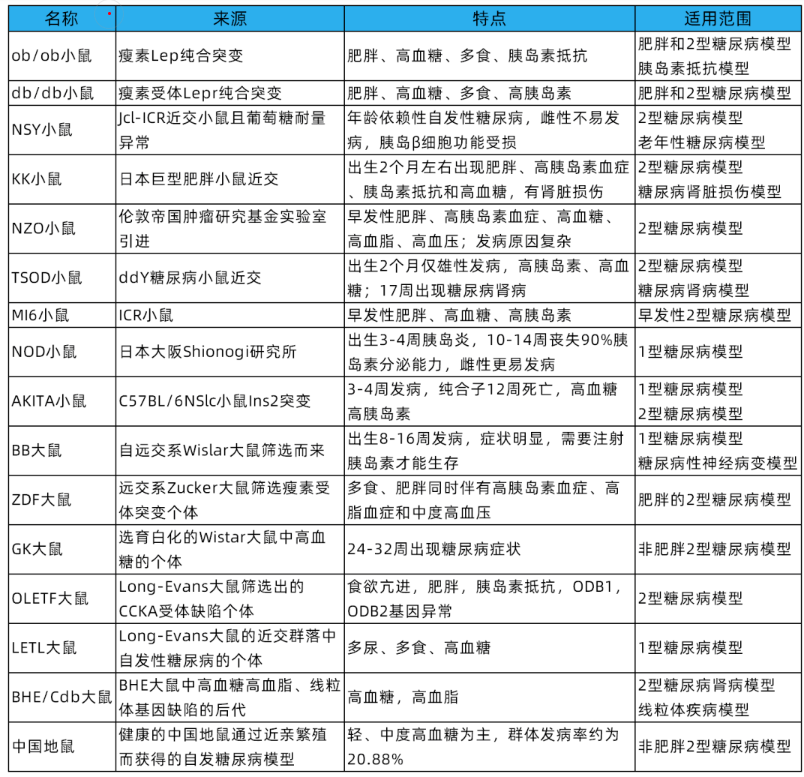
自發(fā)性糖尿病動(dòng)物模型是指在自然條件下,未經(jīng)過人工處理而發(fā)生糖尿病的實(shí)驗(yàn)動(dòng)物,且其后代仍大概率患糖尿病。常見的自發(fā)性糖尿病有NOD小鼠、ob/ob小鼠、db/db小鼠、BB大鼠、LETL大鼠等。自發(fā)性模型動(dòng)物糖尿病的發(fā)生發(fā)展進(jìn)程與人類的糖尿病相似,在糖尿病研究上應(yīng)用廣泛,常用自發(fā)性糖尿病大小鼠模型如下表所示。
化學(xué)藥物誘導(dǎo):已發(fā)現(xiàn)多種化合物可在動(dòng)物模型誘發(fā)糖尿病,其中鏈脲佐菌素(Streptozotocin,STZ)和四氧嘧啶(Alloxan,ALX)是最常用的,這兩種藥物都是細(xì)胞毒性葡萄糖類似物,對(duì)GLUT2轉(zhuǎn)運(yùn)體具有高度親和力,主要破壞胰島β細(xì)胞[2]。比起ALX,STX因其具有更好的穩(wěn)定性和更小的毒性而更受歡迎。若在大小鼠懷孕期間,進(jìn)行STZ誘導(dǎo)則可以構(gòu)建GDM模型。但這種方法存在一定的風(fēng)險(xiǎn),可能導(dǎo)致孕鼠流產(chǎn),且STZ對(duì)胰島的破壞是不可逆的,而一般GDM患者血糖在產(chǎn)后能恢復(fù)正常,因此實(shí)驗(yàn)動(dòng)物可以在產(chǎn)后再移植一個(gè)正常的胰島,但是這個(gè)手術(shù)難度高且成本不菲。
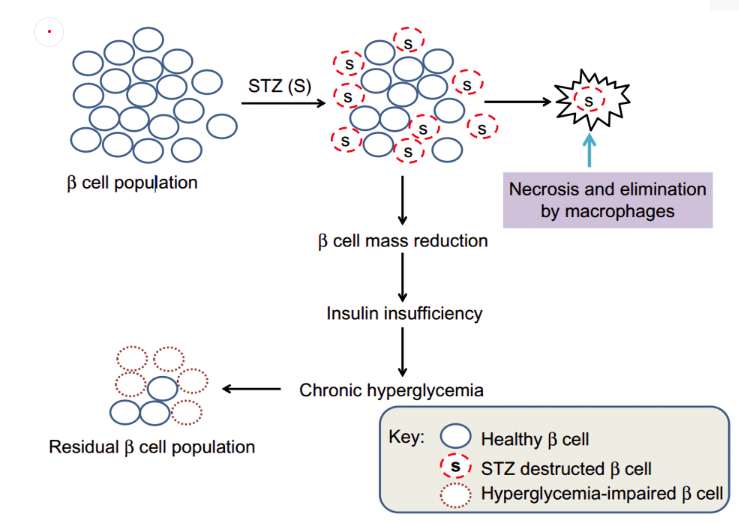
圖4.STZ破壞胰島β細(xì)胞原理圖[6]
飲食誘導(dǎo)(DIO):飲食誘導(dǎo)的動(dòng)物糖尿病模型與人類糖尿病相似,常用來研究飲食、基因等因素與肥胖/糖尿病等疾病進(jìn)程之間的關(guān)系。例如C57BL/6小鼠持續(xù)高脂飲食飼喂14周左右,檢測(cè)糖尿病相關(guān)指標(biāo),這類模型可用于肥胖、II型糖尿病研究。

圖5.DIO肥胖小鼠
手術(shù)誘導(dǎo):直接全部或大部分切除實(shí)驗(yàn)動(dòng)物的胰腺,如果連續(xù)兩天血糖值超11.1mmol/L或者葡萄糖耐量試驗(yàn)120min時(shí)的血糖值仍未恢復(fù)到注射前水平則認(rèn)為DM造模成功。該技術(shù)必需經(jīng)過專門技術(shù)訓(xùn)練且需配套的手術(shù)設(shè)備,還需消除外分泌胰腺消化酶和其他胰島激素的混雜效應(yīng)的影響,因此其廣泛應(yīng)用受到限制[4]。
利用基因修飾技術(shù)對(duì)特定DNA片段進(jìn)行定點(diǎn)敲除、敲入以及替換來實(shí)現(xiàn)基因表達(dá)的上調(diào)或下調(diào),從而構(gòu)建相關(guān)基因型的糖尿病動(dòng)物模型。這類模型可以穩(wěn)定遺傳,有利于研究糖尿病及其并發(fā)癥的發(fā)病機(jī)制,并可用于糖尿病藥物的篩選和藥理藥效研究。
Ins2-C96Y點(diǎn)突變小鼠
研究發(fā)現(xiàn)若小鼠胰島素A鏈中的第七個(gè)氨基酸Cys96(TGC)變?yōu)門yr(TAC),會(huì)導(dǎo)致胰島素A鏈和B鏈之間的一個(gè)關(guān)鍵二硫鍵無法形成,從而導(dǎo)致小鼠proinsulin-2蛋白的錯(cuò)誤折疊這些錯(cuò)誤折疊的蛋白的積累最終會(huì)導(dǎo)致內(nèi)質(zhì)網(wǎng)應(yīng)激和胰島β細(xì)胞凋亡[3]。這個(gè)突變是Akita小鼠自發(fā)糖尿病的原因,據(jù)此我們構(gòu)建了Ins2-C96Y點(diǎn)突變小鼠模型,并觀察到從4周齡開始,Ins2-C96Y雜合子小鼠就表現(xiàn)出多食、多飲、高血糖、體重不增的明顯糖尿病癥狀,且癥狀隨著年齡增長(zhǎng)而加重,上述研究結(jié)果表明Ins2-C96Y小鼠可作為I型糖尿病研究的動(dòng)物模型。
Ins2-C96Y的詳細(xì)介紹可以移步我們往期推文:
疾病小鼠模型系列之I型糖尿病篇(上)
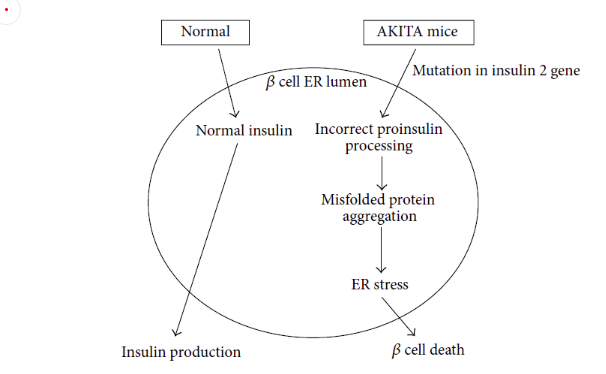
圖6.Akita小鼠發(fā)病基本原理
胰腺特異性敲除PRLR小鼠
孕鼠STZ誘導(dǎo)構(gòu)建GDM模型的難度較高,因此有研究者嘗試構(gòu)建基因修飾的GDM模型。2019年,NteebaJ等構(gòu)建了PRLR-flox小鼠,催乳素受體(PRLR)是孕期維持體內(nèi)血糖穩(wěn)態(tài)的關(guān)鍵分子,敲除PRLR基因能導(dǎo)致妊娠期β細(xì)胞不能正常擴(kuò)增,體內(nèi)葡萄糖穩(wěn)態(tài)受損。將PRLR-flox小鼠和pdx1-Cre(胰島特異性Cre工具鼠)交配,得到的陽性子代在懷孕時(shí)能成功觀察到GDM的表型[10]。
GK/IRS-1雙基因敲除小鼠
IRS-1-/-小鼠表現(xiàn)為胰島素抵抗,但由于β細(xì)胞代償性增生,胰島素分泌增多,糖耐量正常。β細(xì)胞特異GK表達(dá)降低的小鼠,顯示輕度糖耐量異常。兩者雜交產(chǎn)生的GK/IRS-1雙基因剔除小鼠,表現(xiàn)Ⅱ型糖尿病癥狀,既有胰島素抵抗又有糖耐量異常。
Gck敲除/Hnf4a敲除/Abcc8敲除等模型
Gck、Hnf4a、Abcc8等基因與胰島β細(xì)胞發(fā)育、功能或胰島素信號(hào)通路有關(guān),這些由基因突變導(dǎo)致的糖尿病統(tǒng)稱為單基因糖尿病。它們的臨床癥狀與T2DM和T1DM類似,常被誤診,導(dǎo)致患者得不到正確的治療。
葡糖激酶基因(Gck)被稱為“葡萄糖感受器”,不僅是糖代謝過程中關(guān)鍵的限速酶,在β細(xì)胞中它還可以通過感受血糖水平調(diào)節(jié)胰島素的分泌。Gck突變會(huì)導(dǎo)致輕度空腹血糖升高和輕度胰島分泌功能異常[9]。
Hnf4a主要表達(dá)于肝臟,但在胰腺和腎臟上也有表達(dá),該基因編碼的轉(zhuǎn)錄因子通過多種途徑影響糖代謝,Hnf4a突變會(huì)導(dǎo)致高胰島素血癥和巨大兒的癥狀[10]。
Abcc8基因編碼在胰島素分泌中起重要作用的KATP通道的SUR1調(diào)節(jié)亞單位,其突變可影響鉀離子通道關(guān)閉和β細(xì)胞膜的去極化、抑制胰島素分泌,導(dǎo)致常染色體顯性遺傳性糖尿病[11]。
構(gòu)建上述關(guān)鍵基因的敲除模型和條件性敲除模型,可用于單基因糖尿的機(jī)制研究,是提高單基因糖尿病個(gè)體化精準(zhǔn)診治水平的關(guān)鍵。
GLP-1R人源化模型
胰高血糖素樣肽-1受體(glucagon-like peptide-1 receptor, GLP-1R)廣泛分布在胰島、胃、小腸、心臟、腎臟、肺、大腦等組織器官中, 當(dāng)它被GLP-1或人工合成的GLP-1R激動(dòng)劑激活后,便能發(fā)揮多種不同的生理功能。GLP-1R的主要作用是和胰高血糖素樣肽-1結(jié)合,調(diào)節(jié)血糖,它是治療2型糖尿病最有效的靶點(diǎn)之一[8]。如果能在小鼠上敲入人源的GLP-1R基因,讓小鼠表達(dá)人源GLP-1R,就可以直接使用小鼠來篩選糖尿病藥物,并初步分析候選藥物的藥理藥效,把曾經(jīng)要到志愿者身上才能驗(yàn)證的一些藥物性能提前到小鼠上實(shí)現(xiàn),可以大大節(jié)約藥物開發(fā)的成本和時(shí)間。
關(guān)于GLP-1R人源化模型的詳細(xì)介紹可以查閱我們的往期推文:
GLP-1R丨2型糖尿病治療的明星靶點(diǎn)
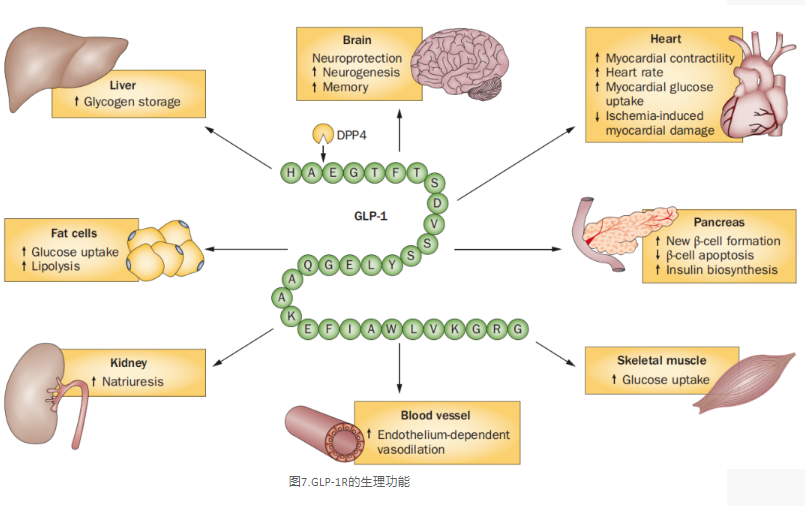
圖7.GLP-1R的生理功能
優(yōu)吉鼠庫(kù)糖尿病動(dòng)物模型
南模生物優(yōu)吉鼠模型資源庫(kù)含多種自主構(gòu)建的基因修飾糖尿病研究模型,可用于糖尿病的基礎(chǔ)研究和藥物開發(fā),詳細(xì)模型信息見下表:
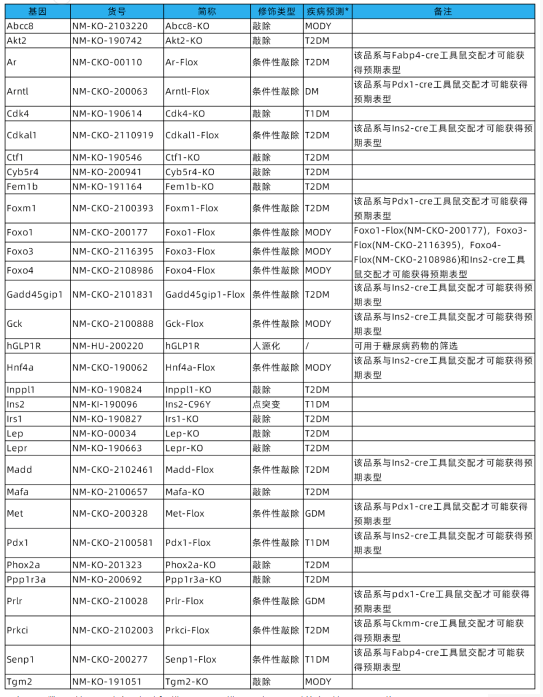
*:疾病預(yù)測(cè)數(shù)據(jù)是基于已發(fā)表文獻(xiàn)中的近似模型 (與公司模型具有相似的構(gòu)建策略或基因型)預(yù)測(cè)獲得。
南模生物深耕基因編輯領(lǐng)域,提供全方位模式生物服務(wù),包括基因修飾成品模型供應(yīng)、個(gè)性化模型定制、飼養(yǎng)繁育、表型分析、藥效評(píng)價(jià)等,滿足不同實(shí)驗(yàn)室需求。
參考文獻(xiàn):(上下滾動(dòng)查看更多)
[1]中國(guó)2型糖尿病防治指南(2020版)
[2]KachapatiK,AdamsD,BednarK,etal.Thenon-obesediabetic(NOD)mouseasamodelofhumantype1diabetes.MethodsMolBiol.2012;933:3-16.
[3]LeMayC,ChuK,HuM,etal.Estrogensprotectpancreaticbeta-cellsfromapoptosisandpreventinsulin-deficientdiabetesmellitusinmice.ProcNatlAcadSciUSA.2006Jun13;103(24):9232-7.
[4]KleinertM,ClemmensenC,HofmannSM,etal.Animalmodelsofobesityanddiabetesmellitus.NatureReviewsEndocrinology,2018,14(3).
[5]https://www.who.int/zh/news-room/fact-sheets/detail/diabetes
[6]WuJ,YanLJ.Streptozotocin-inducedtype1diabetesinrodentsasamodelforstudyingmitochondrialmechanismsofdiabeticβcellglucotoxicity.DiabetesMetabSyndrObes.2015Apr2;8:181-8.
[7]NteebaJ,KubotaK,WangW,etal.Pancreaticprolactinreceptorsignalingregulatesmaternalglucosehomeostasis.JEndocrinol.2019;241(1):71–83.doi:10.1530/JOE-18-0518
[8]Laviola L, Leonardini A, Melchiorre M, et al. Glucagon-like peptide-1 counteracts oxidative stress-dependent apoptosis of human cardiac progenitor cells by inhibiting the activation of the c-Jun N-terminal protein kinase signaling pathway. Endocrinology, 2012, 153 : 5770–5781. DOI:10.1210/en.2012-1461
[9]McDonald, T. J. & Ellard, S. Maturity onset diabetes of the young: identification and diagnosis. Annals of clinical biochemistry 50,403-415,doi:10.1177/0004563213483458 (2013).
[10] Anik, A., Catli, G., Abaci, A. & Bober, E. Maturity-onset diabetes of the young (MODY): an update. Journal of pediatric endocrinology & metabolism : JPEM 28, 251-263, doi:10.1515/jpem-2014-0384 (2015).
[11]Wen, X. & Yang, Y. Emerging roles of GLIS3 in neonatal diabetes, type 1 and type 2 diabetes. Journal of molecular endocrinology 58, R73-R85, doi:10.1530/JME-16-0232 (2017).





 17312606166
17312606166 加微信獲取對(duì)接
加微信獲取對(duì)接