不知道大家有沒有發現����,大多數傳統節日,都繞不開吃�,更別提長達7天的春節���!每到春節�,大家每天不是正在吃�,就是在去吃的路上,小編是被安排得明明白白���,雖然都說"每逢佳節胖三斤",但這話要是放到春節“還有只胖三斤這種好事���?”而過了春節,如何減去一身肥膘都能迅速躥升為熱門話題。今天�,小編就和大家聊聊肥胖����。
肥胖簡介
肥胖在中國已成為重大公共衛生問題�。中國超重與肥胖的發病率和增長速度均居世界首位,現已成為世界上超重和肥胖人數最多的國家。根據《中國居民營養與慢性病狀況報告(2020年)》最新數據����,目前中國的成人中已經有超過1/2的人超重或肥胖���,成年居民(≥18歲)超重率為34.3%�、肥胖率為16.4%���。這是首次中國成人超重和肥胖患病率>50%�,預計到2030年,中國成人超重及肥胖患病率將達到61%[1]���。
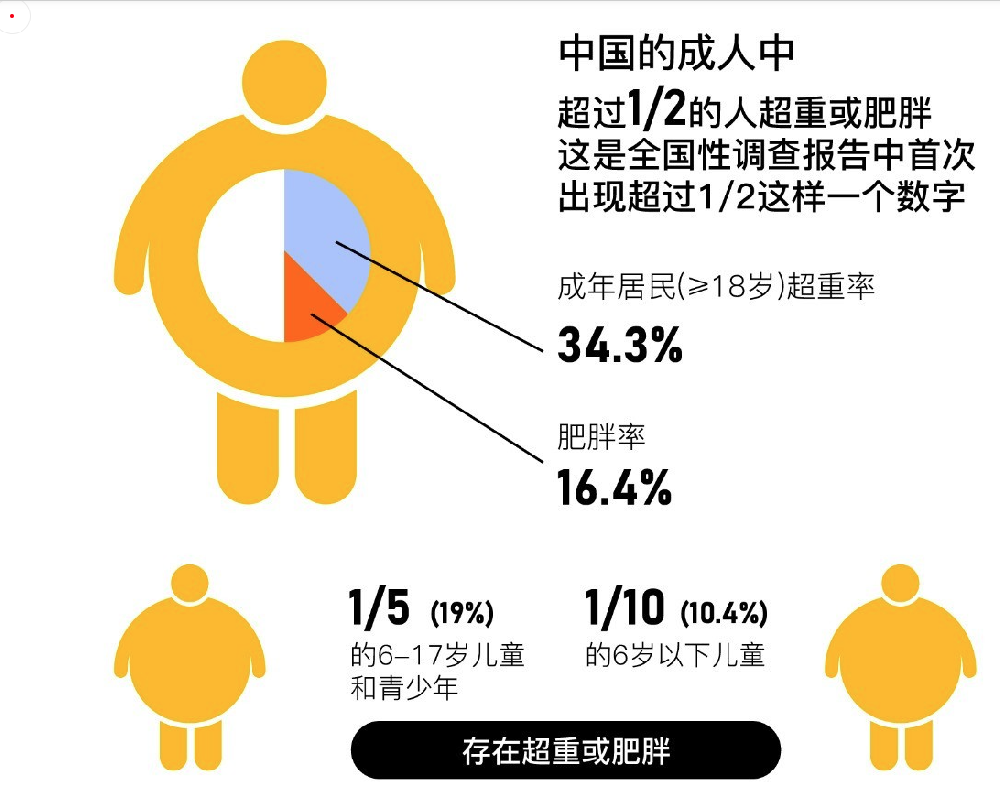
圖1.中國肥胖人群概況
超重和肥胖的定義是可損害健康的異常或過量脂肪累積�。臨床上�,常用身體質量指數(BMI����,Body Mass Index )來評估肥胖與否。BMI(kg/m2)=體重(kg)/身高(m2),目前對于肥胖的診斷標準因地區���、種族����、不同學會等標準仍不統一���。WHO診斷標準:BMI 18.5~25.0 kg/m2為正常體質量�,25.0~29.9 kg/m2為超重����,≥30 kg/m2為肥胖。中國肥胖工作組和中國糖尿病學會將BMI<18.5 kg/m2定義為體質量過低,BMI 18.5~23.9 kg/m2定義為正常體質量,BMI 24.0~27.9 kg/m2定義為超重,BMI>28.0 kg/m2定義為肥胖[2]�。

圖2.肥胖的常見原因(圖片來自網絡)
肥胖和超重的根本原因是攝入卡路里與消耗卡路里之間的不平衡���。隨著生活條件的進步和城市化的發展���,一方面人們越來越容易接觸到各類美食����,另一方面體力勞動和運動的比例卻在飛速降低���,這些都導致國人越來越胖。如果肥胖僅僅只是多長幾斤肥膘那并沒什么好擔心的,但是研究表明肥胖與眾多疾病密切相關�,如:心血管疾?��。ㄖ饕切呐K病和中風)����,糖尿病,肌肉骨骼疾?��。ㄌ貏e是骨關節炎——關節的一種高度致殘退行性疾?���。?,某些癌癥(子宮內膜癌���、乳腺癌���、卵巢癌、肝癌����、結直腸癌等)�,除此之外����,肥胖還可能帶來一系列嚴重的心理問題[2]�。
肥胖的研究進展
龐大的肥胖人群疊加人們對美無止境的追求,讓肥胖成了一個經久不衰的研究熱點����。前文講過肥胖與體內脂肪堆積過多或分布異常相關���,而異常分布的脂肪組織會分泌不同的脂肪因子����,包括瘦素���、抵抗素�、脂聯素和IL-6等[5,6]。根據生理環境����,脂肪組織釋放脂肪因子選擇性地影響組織器官的功能及全身代謝����,如調節食欲����、激素和酶活性等���。例如����,隨著肥胖的發展,脂肪細胞體積不斷變大����,并出現代謝異常�,分泌的脂肪因子由抗炎因子轉變為大量促炎因子����。脂肪因子很可能成為減重和代謝治療的新靶點。
圖3.脂肪組織代謝異常
脂肪組織可以按照結構和功能分為白色脂肪(WAT)、典型的棕色脂肪(BAT)和介于二者中間的米色脂肪(Beige/Brite)。白色脂肪主要以三酰甘油的形式儲存過剩的能量����,與胰島素抵抗�、代謝綜合征以及T2DM等代謝疾病相關;而典型棕色脂肪則主司產熱和葡萄糖代謝;米色脂肪細胞則是二者的中間轉換型,既可像棕色脂肪消耗能量����,亦可嵌入白色脂肪組織?��,F有研究顯示���,棕色脂肪可通過腸-BAT-腦軸產生飲食誘導的產熱效應并抑制高熱量進食行為����,此外,低溫刺激可促進棕色脂肪的葡萄糖攝取率����。基于此���,棕色脂肪被學界認為是未來減重療法的切入點[7]���。
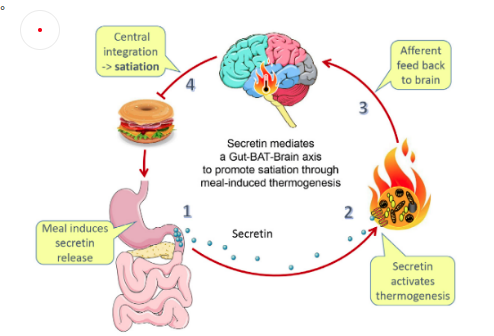
圖4.棕色脂肪誘導的產熱并抑制進食
為了助力脂肪組織相關的基礎研究,南模生物在小鼠脂肪組織特定marker基因中敲入Cre重組酶元件�,構建了多種Cre工具鼠�。具體模型信息見下表:
南模編號 | 品系簡稱 | 表達位置 | 品系狀態 |
NM-KI-190105 | Ucp1-Cre | 棕色脂肪細胞 | 活體 |
NM-KI-190102 | Ucp1-CreERT2 | 棕色脂肪細胞 | 胚胎凍存 |
NM-KI-200060 | Fabp4-2A-DreERT2 | 脂肪細胞 | 活體 |
NM-KI-190034 | Plin1-2A-DreERT2 | 棕色脂肪細胞 | 胚胎凍存 |
NM-KI-200026 | Gja1-2A-DreERT2 | 脂肪細胞 | 活體 |
肥胖的人群快速增長�,我們迫切的需要更加安全有效的治療方法����。合適的動物模型不但可以縮短基礎研究的時間,也可以加速減肥藥物從實驗室研究到臨床應用的步伐。當使用動物模型進行肥胖研究時����,存在各種干擾因素�,如遺傳背景���、飲食���、性別等���,我們需要根據自己的實驗設計選擇合適的模型����。下面小編將對肥胖研究中常用的小鼠、大鼠模型進行詳細介紹[4]。
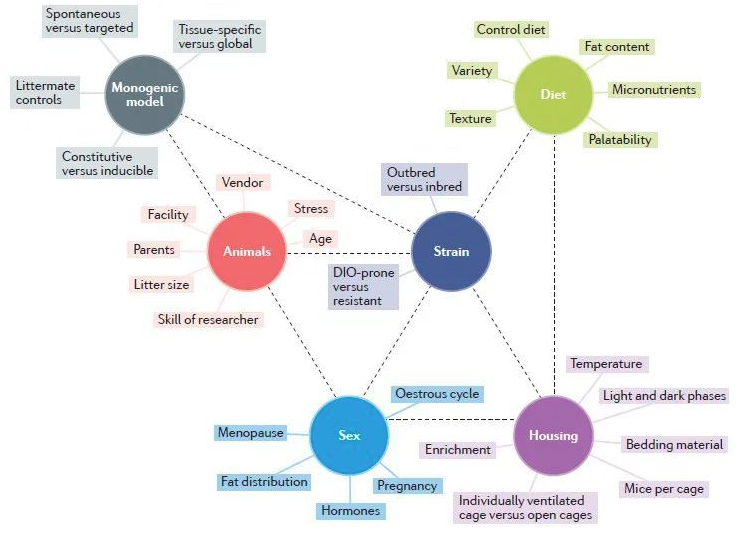
圖5.模型影響因素
1.食物誘導模型
飲食誘導的動物肥胖模型與人類肥胖相似,而且能較好反映人體肥胖的發病機制�,比如體重的緩慢增加和繼發的胰島素抵抗����。但是模型建立耗時較長�,成本較高,實驗結果受品系、性別�、年齡���、飲食����、表觀遺傳等因素影響較大�。
品系:近交系的遺傳差異影響其對飲食誘導的肥胖和糖尿病的易感性。C57BL/6J常用于飲食誘導肥胖(diet-induced obesity,DIO)模型,因為它易于發展為嚴重肥胖�、脂肪積累�、葡萄糖耐受不良和中度胰島素抵抗����。而其他近交系如SWR/J和 A/J小鼠對于DIO及相關并發癥敏感性低����,使其成為研究人類肥胖抵抗的理想模型。但對于藥物抗糖尿病藥效研究���,DIO C57BL/6J小鼠模型并不是理想的選擇,因為該品系很少發展成高血糖癥或胰島萎縮���,而C57BL/6N品系小鼠經過3周高脂飲食即可出現肝脂肪變性、高血糖癥和高胰島素血癥���。DIO的大鼠品系之間也存在差異,常用大鼠為遠交品系���,如Sprague Dawley、Wistar����、LongEvans等���。
圖6.C57BL/6J小鼠
性別:雄性小鼠更容易發生DIO����,并且比雌性小鼠進展更快且程度更大���。飲食誘導的胰島素抵抗性別差異顯著�,比如肥胖程度相近,4個月雄性Zucker Diabetic Fatty (ZDF)大鼠會出現嚴重的高血糖癥和低胰島素血癥�,而雌性ZDF大鼠則終其一生保持正常的血糖水平和胰島素水平���。目前�,臨床前研究普遍使用雄性大小鼠���,雌性嚙齒動物備受冷落���,因為雌性發情會引起無法預料的實驗變化����。此外,雄性常具有更明顯的疾病表型���。顯然,這導致了很多前期結果在臨床上缺乏轉化價值���,尤其是在女性肥胖治療上。
年齡:年齡是影響肥胖研究的另一個重要因素���。常用于代謝研究的C57BL/6J小鼠體重隨著年齡增長而增加,在9個月時達到高峰�,老年C57BL/6J小鼠(22月齡)與3月齡小鼠相比肌肉體重減少而脂肪重增加�。另一個重要因素是飲食干預開始時鼠的年齡���,若小鼠年齡較?。?lt;8周,經驗值)時開始喂養HFD�,則隨后的肥胖和肥胖癥表型并不會特別明顯����。
飲食:輕微的飲食差異就可以極大地影響代謝參數和實驗結果���。例如���,大鼠膳食中動物源脂肪(如豬油)對肥胖和胰島素抵抗的影響比植物脂肪更為顯著�。即使細微差異,如不飽和脂肪酸與飽和脂肪酸的比例以及飲食形態(液體與固體)的改變����,都會導致不同的DIO結果。此外,必須考慮食物顆粒的質地和硬度�,研究表明以粉狀低脂飲食喂養的小鼠會自發產生多余脂肪�;同時����,也需要保證營養成分在每個生產批次中可重復性。如果研究目標是評估特定飲食成分的影響����,研究人員還必須注意選擇適當的對照飲食���。

圖7.常見高脂飼料
當前����,人類每天從脂肪中攝取的熱量約占30%�,遠低于諸多DIO研究中嚙齒動物攝入量(40%-60%卡路里來自脂肪),而特殊HFD(近80%的卡路里來自脂肪)研究結果的實際價值就更值得懷疑。此外,大多數實驗性肥胖誘導飲食缺乏人類飲食的復雜性和多樣性���,這也導致DIO的實驗結果缺乏可信度,有一種更好地模擬臨床肥胖人群表現出的享樂性過度食欲替代方法,即在自由飲食中����,嚙齒類動物可以自由地吃到幾種不同的可口高能量“垃圾”食物(除了普通的食物和水)�。因此�,和高脂飲食組相比,自由飲食組有助于出現更顯著的體重增加和更嚴重的糖尿病癥狀。
2. 單基因突變模型
單基因模型適用于新治療靶點的后續驗證����,廣為熟知的如ob/ob和db/db小鼠����、ZDF大鼠等���,這里以ob/ob和db/db小鼠為例簡單介紹其特點����。這兩種小鼠由美國緬因州巴港杰克森實驗室的Douglas Coleman發現����,前者表現為嚴重肥胖(obesity�,簡寫為ob)�,后者表現為嚴重糖尿病(diabetes,簡寫為db)�,其命名由此得來����。
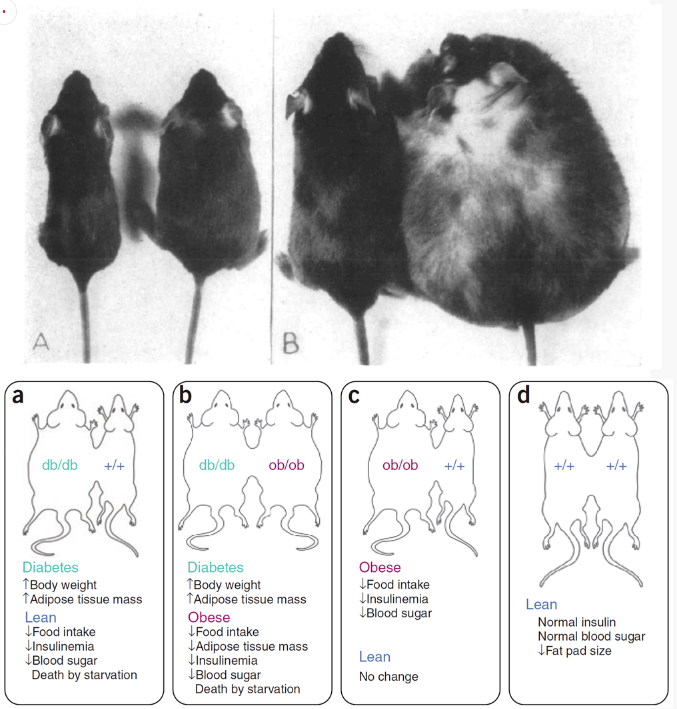
圖8. ob/ob小鼠與聯體共生實驗
Coleman利用ob/ob小鼠����、db/db小鼠和正常小鼠完成了一系列聯體共生實驗。根據實驗結果,Coleman認為正常小鼠的脂肪組織可產生一種活性因子,與受體結合后抑制小鼠進食,減少脂肪儲積����。db/db小鼠產生過量活性因子但是缺乏相應受體����,ob/ob小鼠無法產生活性因子但是相應受體正常����。這個猜想完美解釋了實驗結果,但Coleman一直未能找到這個因子�。直到1994年����,Jeffrey Friedman利用定位克隆技術才發現了小鼠肥胖基因以及人類同源基因���,后通過免疫學方法確定了肥胖基因的產物并將其命名為瘦素(leptin)�,關于ob/ob小鼠和db/db小鼠的爭論至此方塵埃落定����。
3.單基因編輯模型
通過靶向基因突變/敲除可研究目標基因的生理功能,但是這種方式存在一定局限性���。主要原因在于生物體在發育過程中存在代償機制,突變或者被敲除基因的功能可由其他基因代償�。比如GLP-1R胚系基因敲除小鼠給予高脂飲食后并未表現為肥胖����,而且糖耐量僅輕度受損�。如果單純看這個結果,GLP-1RA類藥物基本上不會帶來代謝獲益���,但實際上GLP-1RA是當前治療肥胖和T2DM的同類最佳藥物。
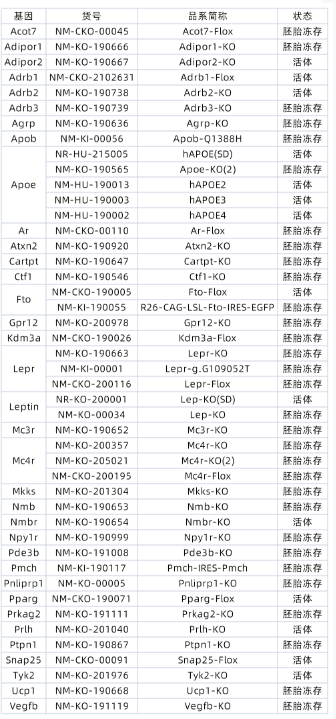
目前研究者們已經從449個突變系27000只小鼠系統表型篩選中發現了50多個與葡萄糖穩態�、代謝或肥胖表型參數相關的基因���,如Leptin���、ApoE���、ApoB����、Ucp1等���,這些基因的敲除小鼠在研究肥胖上發揮著越來越重要的作用����,我們可以預期未來用于肥胖癥和糖尿病的單基因動物模型數量將急劇增加���,南模生物自主構建了多種肥胖相關的基因修飾大小鼠模型���,助力肥胖相關研究�,模型信息詳見下表:
相較于單基因模型,多基因模型能夠更好地模擬人類肥胖/糖尿病的發病機制�,適用于治療有效性和安全性的綜合評價�,比如C57BL6/J小鼠����、Sprague-Dawley大鼠�。即使在相同的遺傳背景下���,多基因模型個體異質性仍比較明顯����。比如在高脂飲食條件下,只有60%的C57BL6/J小鼠和50%的Sprague-Dawley大鼠表現為肥胖�,其余的小鼠/大鼠表型與對照組相似���。這種個體異質性與人類不同個體對肥胖不同程度的易感性遙相呼應�,考慮可能與表觀遺傳相關�。
圖9. 常用肥胖研究模型分類
5.機械誘發模型
機械性損毀下丘腦腹內側可導致過度飲食、體重增加和脂肪儲積等復雜表型����,但畢竟方法略顯原始���。這種機械性手段不僅破壞了神經元���,也破壞了不同腦區之間的神經連接���。目前,研究人員更偏愛采用針對特定腦區、甚至某一腦區特定細胞的靶向基因編輯技術。
結語
當今世界�,不管是發達國家還是發展中國家�,肥胖的患病率都在快速增長����。我們已經身處“肥胖大流行(obesity epidemic)”時代,肥胖研究正當時。無論您需要飲食誘導的肥胖大小鼠���,還是需要基因修飾的肥胖模型,都可以隨時聯系我們!
參考文獻:
[1] 中華醫學會內分泌學分會, 中華中醫藥學會糖尿病分會, 中國醫師協會外科醫師分會肥胖和糖尿病外科醫師委員會, 等 . 基于臨床的肥胖癥多學科診療共識(2021 年版)[J]. 中華消化外科雜志,2021, 20(11): 1137-1152. DOI: 10.3760/cma.j.cn115610-20210829-00422.
[2] https://www.who.int/zh/news-roo?m/fact-sheets/detail/obesity-and-overweight
[3] Nat Rev Dis Primers . 2017 Jun 15;3:17034. doi: 10.1038/nrdp.2017.34. Obesity
[4]Kleinert M, Clemmensen C, Hofmann S M, et al. Animal models of obesity and diabetes mellitus. Nature Reviews Endocrinology, 2018, 14(3).
[5]LanN, LuY, ZhangY, et al. FTO - A Common Genetic Basis for Obesity and Cancer[J]. Front Genet, 2020, 11: 559138. DOI: 10.3389/fgene.2020.559138.
[6]ZhangY, ProencaR, MaffeiM, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372(6505): 425-432. DOI: 10.1038/372425a0.
[7]Endpts.com/kallyope-lands-112-million-series-c-to-ride-the-gut-brain-axis-for-another-3-years/.





 17312606166
17312606166