暨南大學(xué)閆森及涂著池共同通訊在Signal Transduction and Targeted Therapy在線發(fā)表題為“Generation of inactivated IL2RG and RAG1 monkeys with severe combined immunodeficiency using base editing”的研究論文,該研究提出了一種使用CBE4max系統(tǒng)使IL2RG和RAG1基因失活來構(gòu)建免疫缺陷猴模型的方法。經(jīng)過堿基編輯的猴子表現(xiàn)出嚴重受損的免疫系統(tǒng),其特征是淋巴細胞減少、淋巴樣器官萎縮和成熟T細胞缺乏。此外,這些經(jīng)過基因編輯的猴子能夠承載和支持人類乳腺癌細胞的生長,從而導(dǎo)致腫瘤的形成。總之,該研究已經(jīng)成功開發(fā)了一種免疫缺陷猴模型,該模型具有使用CBE4max系統(tǒng)促進腫瘤生長的能力。這些免疫缺陷猴子顯示出作為推進生物醫(yī)學(xué)和轉(zhuǎn)化研究的寶貴工具的巨大潛力。

嚴重聯(lián)合免疫缺陷(SCIDs)包括一組遺傳性疾病,嚴重破壞免疫系統(tǒng)的功能。這導(dǎo)致來自胸腺和骨髓的T細胞和B細胞的缺失或減少,導(dǎo)致細胞和體液適應(yīng)性免疫受損。SCID的發(fā)病機制主要涉及由于嘌呤代謝缺陷、通過常見γ鏈依賴性細胞因子受體的信號傳導(dǎo)異常、V(D) J重組異常以及前TCR/TCR信號傳導(dǎo)缺陷導(dǎo)致的前體淋巴細胞過早死亡一些基因突變已被確定為SCIDs的誘因,包括MALT1、ZAP70、IL21R、FOXN1、CORO1A、RAG1/2、IL2RG、AK2、IKBK2、UNC119、LCK、TTC7A、CARD11和BCL10。其中,IL2RG,也被稱為公共γ鏈,作為IL-21、IL-15、IL-9、IL-4和IL-7受體共有的IL-2受體的亞基。
IL2RG突變導(dǎo)致X連鎖嚴重聯(lián)合免疫缺陷(X-SCID),這是最常見的SCID形式,占所有病例的50%。在X-SCID中,T和NK細胞缺失或明顯減少,而B細胞表現(xiàn)出功能障礙,其數(shù)量正常或增加。另一個與SCID相關(guān)的基因是RAG1,它通過促進發(fā)育中的淋巴細胞V(D)J重組在適應(yīng)性免疫中起關(guān)鍵作用RAG重組酶(RAG1/2)將可變(V)、多樣性(D)和連接(J)基因片段隨機組合,生成V(D)J外顯子,編碼T細胞受體和抗體的可變區(qū)。許多喪失功能的RAG1突變體已被確定為人類SCID的致病因素。這些突變體的特征是部分蛋白表達和T細胞和B細胞的有限產(chǎn)生,同時保持正常NK細胞的功能。
免疫系統(tǒng)受損的動物可分為先天性突變引起的遺傳免疫缺陷或通過生物技術(shù)方法人工誘導(dǎo)的遺傳免疫缺陷。目前,有幾種類型的遺傳免疫缺陷動物模型,如小鼠、大鼠和豬。這些免疫缺陷動物在腫瘤學(xué)、干細胞治療、免疫系統(tǒng)研究和傳染病等領(lǐng)域有廣泛的應(yīng)用。人源化小動物模型在免疫腫瘤學(xué)研究中特別有價值,因為它們提供了臨床轉(zhuǎn)化的潛力。然而,針對具體情況準確選擇合適的模型仍然具有挑戰(zhàn)性。目前還不可能找到一種完全復(fù)制人類生物學(xué)所有方面的小鼠模型,而且一些SCID小鼠隨著年齡的增長會出現(xiàn)“免疫泄漏”。這些“泄漏”導(dǎo)致小鼠產(chǎn)生少量功能性T細胞和B細胞,以及免疫球蛋白。SCID小鼠免疫泄漏背后的分子機制尚不清楚,目前還沒有確定的診斷標準。非人靈長類動物(NHPs)在系統(tǒng)發(fā)育上與人類高度相關(guān),在生理上有許多相似之處,包括免疫系統(tǒng)特征NHPs與人類在遺傳和生理上的相似之處使它們成為生物醫(yī)學(xué)研究的優(yōu)秀模型。因此,建立免疫缺陷猴模型勢在必行。
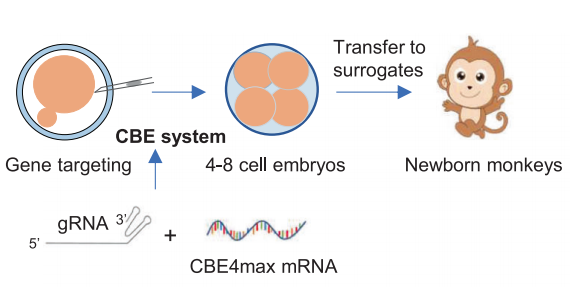
堿基編輯猴的生成過程示意圖(圖源自Signal Transduction and Targeted Therapy)
雖然CRISPR/Cas9有望用于治療和生物學(xué)研究,但由于它依賴DNA雙鏈斷裂(DSBs)來促進基因編輯,因此引起了人們的擔憂。CRISPR/Cas9誘導(dǎo)的DSBs可導(dǎo)致數(shù)千個堿基對的缺失,從而導(dǎo)致可能對有絲分裂活性細胞產(chǎn)生有害影響的基因型的產(chǎn)生。例如,當應(yīng)用于人類多能干細胞時,CRISPR/Cas9可以誘導(dǎo)p53突變,限制了細胞替代療法的可行性。此外,基因編輯的效率受到插入缺失突變的高頻率的阻礙,在HEK293T細胞中,CRISPR介導(dǎo)的同源定向修復(fù)率僅達到38%。
然而,大多數(shù)已知的遺傳疾病主要是由單核苷酸多態(tài)性(SNPs)引起的。因此,需要能夠在不引入DSBs的情況下特異性地修改目標位點上的單個堿基對的方法。堿基編輯器提供了可編程性和靈活性,消除了對DSBs的需求,克服了傳統(tǒng)Cas9核酸酶在基因編輯中的局限性。胞嘧啶堿基編輯器(CBEs)具有胞嘧啶脫氨酶活性,已被有效地用于在包括人類、小鼠和作物在內(nèi)的各種生物體的基因組中引入精確的單堿基突變。與CBE4相比,CBE4max系統(tǒng)是C-G到T-A轉(zhuǎn)化的增強工具,已在小鼠模型中開發(fā)和驗證,隨后對哺乳動物物種進行了優(yōu)化。
該研究利用CBE4max系統(tǒng)在IL2RG和RAG1基因中引入特異性單核苷酸替代,成功實現(xiàn)了非人靈長類動物免疫缺陷模型的生成。堿基編輯過程導(dǎo)致被編輯猴子的免疫系統(tǒng)明顯受損,表現(xiàn)為淋巴細胞減少、淋巴樣器官萎縮和缺乏成熟T細胞。此外,研究人員觀察到人類乳腺癌細胞在堿基編輯的猴子體內(nèi)存活和增殖的顯著能力。這些有免疫缺陷的猴子是臨床前研究的寶貴工具,并彌合了小動物模型與人類之間的差距。它們的利用可以顯著提高臨床前研究的有效性,為抗癌藥物的開發(fā)和再生醫(yī)學(xué)領(lǐng)域的異源細胞或器官移植提供依據(jù)。





 17312606166
17312606166