摘要:淋巴祖細胞的分化是淋巴管生成的關鍵步驟。 然而,其潛在機制仍不清楚。在這里,我們發現非經典蛋白酶激活受體 1 (par1) 調節斑馬魚胚胎淋巴祖細胞的分化。通過下調脊索旁淋巴管母細胞中prox1a的表達,par1功能喪失而損害淋巴管分化,并導致斑馬魚胸導管形成受損。同時,par1 下游效應子 G 蛋白 gnai2a 是斑馬魚淋巴發育的選擇性必需蛋白,其突變模擬了 par1 突變體中觀察到的淋巴管表型。有趣的是,斑馬魚淋巴管發育需要mmp13,而不是凝血酶。此外,對遺傳相互作用的分析證實,mmp13b作為par1上游蛋白酶調節斑馬魚胚胎的淋巴管發育。機制上,par1促進后主靜脈flt4表達和磷酸化Erk1/2活性。總之,我們的發現強調了par1在斑馬魚胚胎淋巴管分化調節中的作用。
關鍵詞:生物科學 分子生物學 免疫學 斑馬魚
簡介:淋巴系統是一個復雜的脈管系統,起源于預先存在的胚胎靜脈。 它在維持組織間液平衡和回收水和大分子、吸收脂質以及為免疫細胞參與免疫監視系統提供主要管道等方面具有重要作用。淋巴系統畸形可導致許多病理,例如組織液積聚、水腫或淋巴水腫、癌細胞擴散和炎癥。在小鼠淋巴系統發育過程中,靜脈內皮細胞 (VEC) 亞群表達轉錄因子 prospero 同源盒蛋白 1 (PROX1),并在胚胎第 9.5 天分化為主靜脈 (CV) 中的淋巴祖細胞。小鼠 prox1 的消融可防止淋巴管的發育,并且 prox1 在血管內皮細胞 (ECs) 中的異位表達可上調淋巴管內皮細胞 (LEC) 標志物。這些研究表明 prox1 是誘導 LEC 命運的必要和充分條件。在斑馬魚胚胎中,在受精后約 26 小時 (hpf) 早期在腹后主靜脈 (PCV) 內誘導淋巴祖細胞。大約 48 hpf這些淋巴祖細胞遷移到水平肌中隔 (HM) 區域,形成脊索旁淋巴母細胞 (PLs),這是一個淋巴前體細胞庫。隨后,PLs向兩個方向遷移,腹側形成胸導管(TD),背側形成背側縱向淋巴管(DLLV);在受精后5天(dpf)左右完成。母體和合子prox1a突變體導致斑馬魚胚胎淋巴管發育缺陷,表明其在淋巴管系統中的保守作用。最近的研究表明,Vegfc-Flt4及其下游效應子Erk1/2在斑馬魚軀干中的一個關鍵作用是誘導prox1a表達。蛋白酶激活受體1(PAR1)是一種G蛋白偶聯受體(GPCR),更具體地說,是一種凝血酶受體(F2r),在血管生物學中起著關鍵作用。它通過絲氨酸蛋白酶凝血酶 (F2) 在典型位點切割 N 末端外結構域而被激活。然而,已發現其他 PAR1 上游蛋白酶可激活 PAR1。例如,基質金屬蛋白酶(MMPs),特別是MMP1和MMP13,也可以在非標準位點切割和激活PAR1,從而形成與F2不同的信號模式。一旦PAR1在標準或非標準位點被不同蛋白酶不可逆地切割和激活,PAR1可以偶聯并激活多個異源三聚體G蛋白亞型,包括G12/13、G11/q和GI。這導致多種細胞信號事件,包括MAPK/ERK信號的激活。據報道,Par1在斑馬魚的造血和心血管發育中起著關鍵作用。盡管par1在1 dpf時斑馬魚胚胎的PCV中富集,但其作用仍然未知。在此,我們報告Mmp13b-Par1-Gnai2a軸調節斑馬魚胚胎中淋巴祖細胞的分化。在機制上,我們表明par1通過調節flt4的表達促進Erk1/2活性和prox1a的表達。
par1是斑馬魚胚胎軀干淋巴管發育所必需的:PCV 是斑馬魚胚胎軀干淋巴祖細胞的來源。有趣的是,我們的整體原位雜交(WISH)結果表明,par1 在 26 hpf 的斑馬魚胚胎的 PCV 區域中高度表達,與之前的報告一致。因此,par1可能參與斑馬魚胚胎發育過程中的淋巴管發育。為了研究這一點,我們利用CRISPR/Cas9技術成功地構建了一個斑馬魚par1突變體,該突變體在其第2外顯子中含有103 bp的缺失。我們發現突變體的F2代胚胎似乎是正常的,沒有任何嚴重缺陷。然而,在5 dpf時,他們顯示TD形成受損。正常只有 6% 的體細胞缺乏 TD。 相比之下,par1斑馬魚突變體中近25%的體細胞缺乏TD。此外,突變體平均只有 11.2 個 LEC 核/6 個體節,明顯少于同胞胚胎中的 17.5 個。總之,這些結果證實了 par1 是 TD 形成所必需的,這意味著它在斑馬魚胚胎發生過程中參與了軀干淋巴的發育。
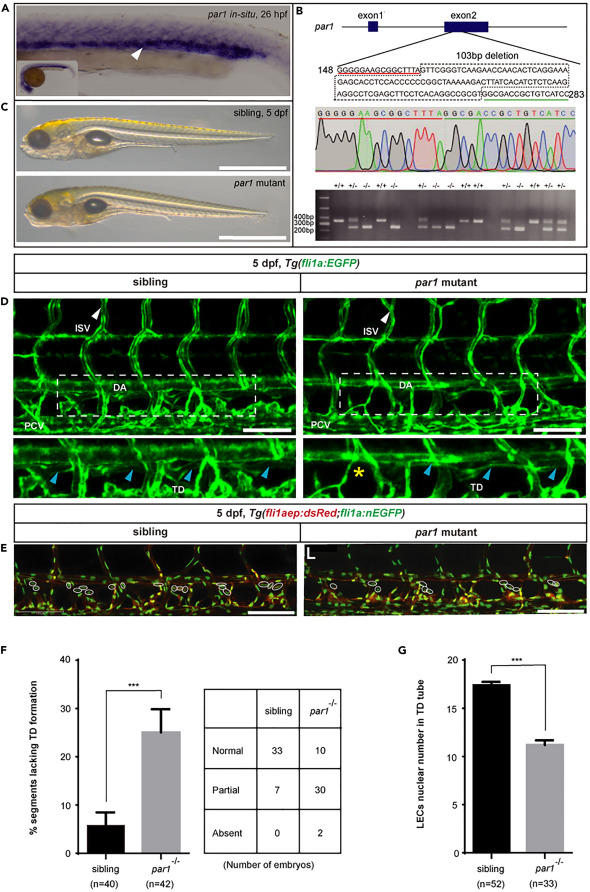
圖1、par1突變斑馬魚胚胎顯示TD形成缺陷
par1調節斑馬魚淋巴祖細胞的分化:在斑馬魚的淋巴管發育過程中,Prox1a陽性內皮細胞在30hpf時從PCV背面出現,在48hpf時形成PLs作為淋巴祖細胞池。同時,血管內皮細胞并行生長形成靜脈節段間血管(vISV),然后與動脈節段間血管(aISV)融合,建立具有交替動脈和靜脈連接的循環網絡。為了確定 par1 是否參與淋巴分化,我們首先進行了全胚胎免疫染色測定,以檢查 54 hpf 時 Tg(fli1a:EGFP)系 PLs 中 Prox1a 的表達。與正常胚胎相比,par1斑馬魚突變體在PLs中表現出prox1a表達減少。伴隨著par1在斑馬魚胚胎中調節prox1a表達的作用,我們使用siRNA方法下調了par1在人類真皮淋巴管內皮細胞(HDLEC)中的表達。有趣的是,PROX1的表達不僅在mRNA水平上顯著降低,而且在蛋白質水平上也顯著降低。這些結果表明PAR1在體內和體外調節PROX1表達中具有保守作用。為了確定par1是否在早期參與靜脈和淋巴管出現,我們將par1突變體與Tg(lyve1b:dsRed;flk1:EGFP)系雜交,其中lyve1b:dsRed標記靜脈和淋巴管。正常胚胎在36 hpf時,幾乎100%的靜脈和淋巴從PCV中出現,而par1突變體在同一階段僅顯示約80%出現。總之,這些結果表明par1是斑馬魚胚胎中淋巴祖細胞分化所必需的。
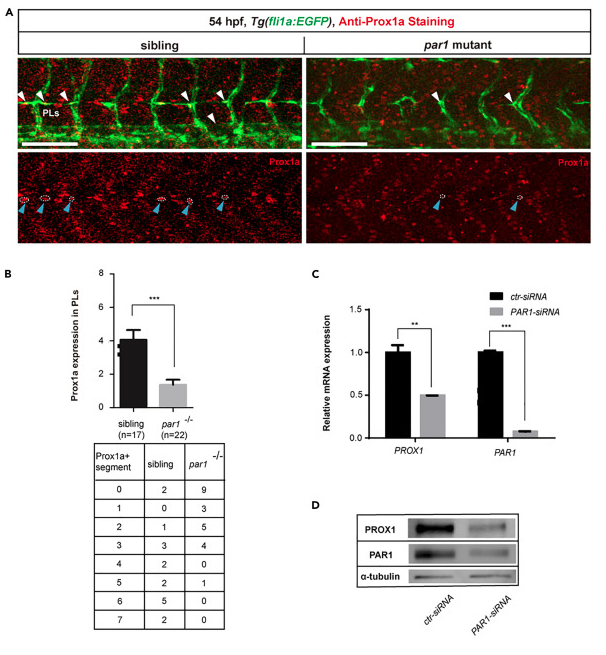
圖2、par1是斑馬魚胚胎淋巴分化所必需的
gnai2a是斑馬魚胚胎軀干淋巴管發育的選擇性必需物質:許多不同的鳥嘌呤核苷酸結合G蛋白α亞單位作為PAR1的下游效應器發揮作用,包括GI、Gq/11和G12/13亞家族的成員。為了尋找參與斑馬魚胚胎par1介導的淋巴管生成的替代G蛋白,我們首先使用來自不同亞類的七種G蛋白(包括GNAQ、GNA11、GNA12、GNA13、GNAI1、GNAI2和GNAI3)對HDLEC進行定量實時PCR(qPCR)分析。我們發現只有GNA11、GNA13和GNAI2具有相對較高的mRNA表達水平。然后,我們使用siRNA方法敲除HDLEC中這三個基因的表達,并驗證PROX1的表達水平。令人驚訝的是,結果表明,僅敲除 GNAI2導致 PROX1 在 mRNA 和蛋白質水平方面的表達顯著下降。這表明GNAI2比其他G蛋白更可能參與調節淋巴管分化。我們通過WISH分析了gnai2同源基因(gnai2a和gnai2b)在斑馬魚胚胎中的表達模式。結果表明,gnai2a,但不是 gnai2b,在PCV 區域中高度表達。為了支持這一結果,我們隨后通過將 gna11a MO、gna11b MO、gna13a MO、gna13b MO 以及 gnai2a MO 注射到單細胞階段的胚胎中進行了敲除分析。有趣的是,我們發現只有gnai2a變體表現出TD形成缺陷,超過50%的體節缺乏TDs。相反,對照胚胎和gna11a、gna11b、gna13a和gna13b變體顯示正常TD形成。這些結果表明,gnai2a是斑馬魚胚胎淋巴發育的選擇性必需物質。
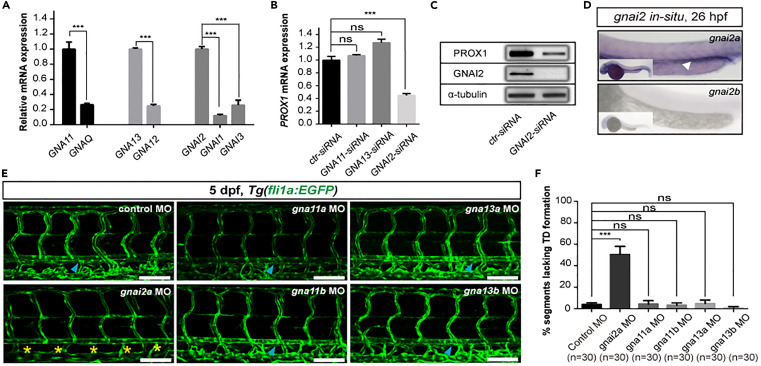
圖3、gnai2a是斑馬魚胚胎淋巴管發育的選擇性必需物質
gnai2a重現了斑馬魚淋巴管發育過程中par1介導的表型:為了研究gnai2a在斑馬魚淋巴管生成過程中的作用,我們使用CRISPR/Cas9技術獲得了一個gnai2a突變體,其外顯子3中有68 bp的缺失。大多數突變體的F2代在5dpf時表現為正常表型。接下來,我們檢測了胚胎發生過程中5 dpf時TD的形成。如圖 4 所示,近 30% 的體細胞在突變體中缺乏 TD,明顯多于正常胚胎。突變體的數量顯著減少,平均為11.7,而正常胚胎的平均為18.2。為了評估gnai2a是否需要調節淋巴管分化,我們在Tg(fli1a:EGFP)胚胎中使用54 hpf的抗Prox1抗體進行了免疫染色分析。我們發現F2代突變體的prox1a陽性PLs比同胞胚胎少。同時,與正常對照胚胎相比我們發現 gnai2a 的敲除導致 36 hpf 時淋巴-靜脈的出現部分失敗。 這表明gnai2a是斑馬魚淋巴管分化所必需的。為了進一步驗證gnai2a在這個過程中是par1的下游效應子,我們使用Tg(fli1a:EGFP)系和Tg(fli1aep:dsRed;fli1:nEGFP)系雜交par1雜合突變體和gnai2a雜合突變體。我們發現野生型胚胎、par1雜合子突變體、gnai2a雜合子突變體和雜交的par1-gnai2a雜合子突變體具有正常的形態,并且在TD形成方面沒有表現出可比的差異。這表明在雜交的par1-gnai2a雜合子斑馬魚突變體中,par1和gnai2a之間存在遺傳相互作用,尤其是在細胞水平上。
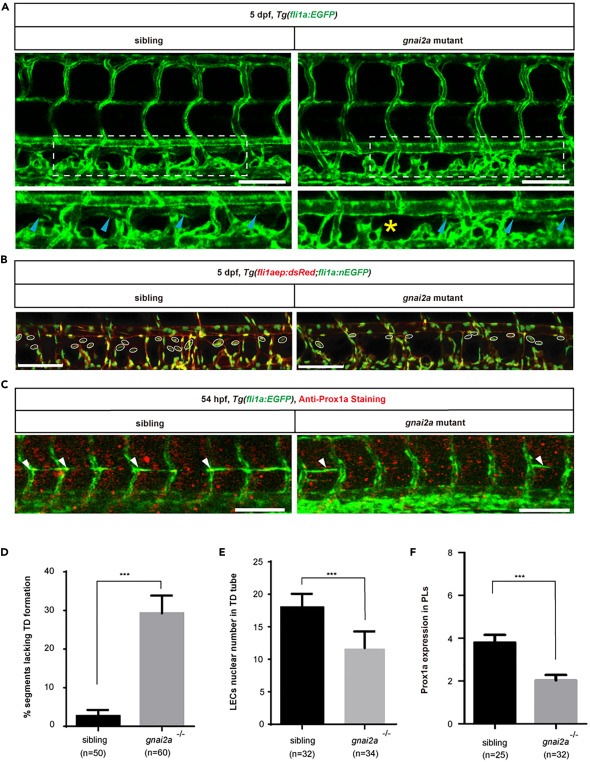
圖 4. gnai2a 突變體模擬 par1 突變體中觀察到的淋巴表型
凝血酶不參與斑馬魚淋巴管生成:F2 是第一個被報道能夠在典型位點切割和激活 PAR1 的配體。為了闡明斑馬魚胚胎淋巴管發育是否需要F2,我們在單細胞階段將F2-MO注入胚胎。在5dpf時,我們分析了TD的形成,意外地發現對照和F2變體都有正常的TD形成。為了進一步驗證這一結果,我們用 SCH79797 處理斑馬魚胚胎,SCH79797 是一種特定的 PAR1 拮抗劑,可阻斷 F2 和 PAR1 之間的相互作用。與上述結果一致,在5dpf時,處理過的胚胎和賦形劑對照胚胎均表現出正常的TD形成,這表明par1在調節斑馬魚淋巴管發育方面獨立于F2。這些結果清楚地表明,斑馬魚淋巴管發育不需要F2。
斑馬魚淋巴管發育需要mmp13b:幾種蛋白酶切割并激活PAR1,包括F2、纖溶酶、活化蛋白C、血小板素、Xa因子、VIIa因子、類胰蛋白酶、胰蛋白酶、基質金屬蛋白酶等。為了尋找參與PAR1調節斑馬魚淋巴管生成的候選蛋白酶,我們首先對HDLEC進行了qPCR分析,并觀察了這些蛋白酶的相對mRNA表達。有趣的是,MMP1的相對mRNA表達最高。接下來,我們將MMP1 siRNA轉染到HDLEC中,并評估PROX1的表達。有趣的是,MMP1的敲除導致PROX1 mRNA表達顯著降低,表明MMP1可能參與淋巴管生成。在人類基因組中,有三種膠原酶(MMP1、MMP8和MMP13)。然而,其中兩個(Mmp1和Mmp8)沒有斑馬魚同源物,在斑馬魚基因組中只有MMP13存在重復(Mmp13a和Mmp13b)。mmp13a 在髓系細胞中表達,但不在靜脈中表達。因此,我們推測 mmp13b 可以替代人類 MMP1 基因的功能,調節par1介導的斑馬魚胚胎淋巴管發育。用WISH觀察斑馬魚胚胎發生過程中mmp13b的表達模式。有趣的是,我們發現它在26 hpf的PCV區域高度表達,表明它與淋巴管有關。我們利用CRISPR/Cas9技術產生了一個斑馬魚mmp13b突變體,并獲得了一個穩定的突變體,其外顯子4中有一個7bp的缺失。為了驗證mmp13b在調節淋巴管生成中的作用,我們檢測了F2代胚胎中TD的形成。正如在par1斑馬魚突變體中觀察到的那樣,mmp13b突變體胚胎在5 dpf時顯示出近25%的體節缺乏TD。54 hpf下PLs中Prox1a表達的免疫染色分析表明,與正常胚胎相比,突變體也顯示出顯著降低的Prox1a表達。總之,這些數據表明mmp13b是斑馬魚淋巴管發育所必需的。
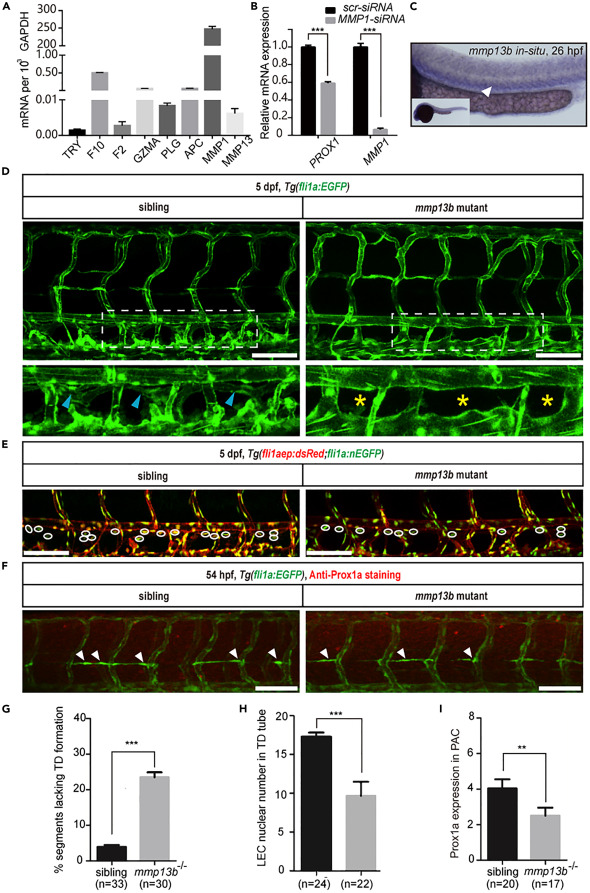
圖 5. mmp13b 突變體模擬 par1 突變體中觀察到的淋巴表型。
par1促進斑馬魚胚胎Erk1/2活性和flt4表達:Vegfc 及其受體 Flt4 通過誘導 prox1a 表達激活 p-Erk1/2,最終調節斑馬魚胚胎淋巴祖細胞的分化。基于以上結果,我們提出par1可能促進Vegfc/Flt4/Erk信號活性,從而調節斑馬魚胚胎的淋巴管生成。為了驗證這一假設,我們使用 F2 代 Tg(fli1a:EGFP) 胚胎進行了全胚胎 p-Erk1/2 免疫染色測定。在 28 hpf 時,當淋巴祖細胞開始從 PCV 背側遷移時,我們在同胞胚胎的 PCV 中觀察到明顯的 p-Erk1/2 染色。然而,par1斑馬魚突變體的PCV染色明顯減少。接下來,為了證實PAR1是否促進VEGFC誘導的p-ERK1/2激活,我們在培養的HDLEC中進行了PAR1敲除實驗,發現PAR1敲除導致VEGFR3 mRNA水平顯著降低。

圖6、par1功能喪失降低斑馬魚胚胎PCV中p-Erk1/2活性和flt4表達
局限性:在本研究中,我們產生了三個突變體,發現mmmp13b-par1-gnai2a軸調節斑馬魚胚胎中淋巴祖細胞的分化。機制上,par1促進后主靜脈flt4表達和磷酸化Erk1/2活性。然而,將mmp13b-par1-gnai2a通路與flt4調節聯系起來的機制需要進一步擴展。
原文出自:Noncanonical protease-activated receptor 1 regulates lymphatic differentiation in zebrafish - ScienceDirect





 17312606166
17312606166